Москва 2015
ВВЕДЕНИЕ
Внебольничная пневмония (ВП) являются актуальной проблемой для педиатрической практики. В последние годы отмечается рост заболеваемости ВП у детей, относительно высокой остается смертность от этого заболевания. В реальной практике, особенно в амбулаторных условиях, серьезными проблемами являются ранняя диагностика и рациональная терапия пневмонии у детей.
В 2010 году при участии 65 экспертов из России и стран СНГ была создана научно-практическая программа «Внебольничная пневмония у детей: распространенность, диагностика, лечение и профилактика» [1], которая издавалась с небольшими переработками в 2011 и 2012 годах. В программе были резюмированы накопленные данные по вопросам этиологии, патогенеза, эпидемиологии, диагностики и лечения ВП у детей. За последние 5 лет было проведено и представлено в мировой научной литературе большое число клинических и эпидемиологических исследований, касающихся пневмонии. К сожалению, в отечественной литературе этой проблеме уделяется недостаточно внимания. В 2013 году Министерством здравоохранения Российской Федерации были приняты новые стандарты медицинской помощи при пневмонии и «Порядок оказания медицинской помощи населению по профилю «пульмонология»». С 2014 года в Национальный календарь профилактических прививок России включена вакцинация против пневмококковой инфекции. В связи с вышесказанным назрела необходимость пересмотра ряда позиций, относительно ВП у детей и создание нового экспертного документа, отражающего современные клинические рекомендации.
Основное внимание в данном документе уделено практическим вопросам диагностики и терапии ВП у детей, и в частности особенностям ведения детей в амбулаторных условиях, включены данные по особенностям ВП у детей с ВИЧ-инфекцией, ДЦП, муковисцидозом. Книга предназначена для педиатров, врачей общей практики, пульмонологов, клинических фармакологов, реаниматологов, а также преподавателей медицинских вузов.
При подготовке клинических рекомендаций авторы пытались строить рекомендации по диагностике и лечению на основе данных доказательной медицины (см.таблицу ). Однако необходимо учитывать, что в настоящее время доказательная база в отношении методов лечения в педиатрии, в том числе по АБТ явно недостаточна, что связано с этическими и деонтологическими проблемами. Также следует учитывать, что эффективность этиотропной терапии пневмонии принципиально зависит от чувствительности возбудителей к АБП, которая имеет значительные региональные особенности и подвержена существенным изменениям.
| Категория доказательств | Источник | Определение доказательств |
|---|---|---|
A |
Рандомизированные контролируемые исследован ия |
Доказательства основаны на хорошо спланированных рандомизированных исследованиях, проведенных на достаточном количестве пациентов, необходимом для получения достоверных результатов. Могут быть обоснованн о рекомендованы для широкого применения |
B |
Рандомизированные контролируемые исслед ования Доказательства основаны на рандомизированных контролируемых исследованиях, однако количество включенных пациентов недостаточно для достоверного статистического анализа. Рекомендации могут быть распространены на ограниченную популяцию C Нерандомизированные клинические исследования |
Доказательства основаны на нерандомизированных клинических исследованиях или исследов аниях, проведенных на ограниченном количестве пациентов |
1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ У ДЕТЕЙ
1.1. Определение
- Пневмония
-
— острое инфекционное заболевание, различное по этиологии (преимущественно бактериальное), характеризующееся очаговыми поражениями легких с внутриальвеолярной экссудацией, что проявляется выраженными в различной степени интоксикацией, респираторными нарушениями, локальными физикальными изменениями со стороны легких и наличием инфильтративной тени на рентгенограмме грудной клетки.
- Внебольничная пневмония (домашняя, амбулаторная)
-
— это пневмония, развившаяся вне больницы или в первые 72 часа госпитализации.
1.2. Классификация
В соответствии с Международной классификацией болезней, травм и причин смерти 10–го пересмотра (МКБ-10) и «Классификацией клинических форм бронхолегочных заболеваний у детей» [2] выделяют следующие формы пневмонии:
-
По этиологии:
-
бактериальная (в то числе, вызванная атипичными бактериями);
-
вирусная;
-
грибковая;
-
паразитарная;
-
смешанная.
-
Классификация по этиологии положена в основу МКБ 10 пересмотра (см приложение A). Однако, широкое использование этиологической классификации пневмонии невозможно, поскольку верификация этиологии ВП отсутствует у большинства пациентов, а клинические симптомы малоинформативны для этиологической диагностики.
-
По морфологии:
-
очаговая — один или несколько очагов пневмонической инфильтрации размером 1–2 см;
-
очагово-сливная (псевдолобарный инфильтрат) — неоднородная массивная пневмоническая инфильтрация, состоящая из нескольких очагов. Может осложняться деструктивными процессами и экссудативным плевритом;
-
сегментарная — границы повторяют анатомические границы одного сегмента;
-
полисегментарная — границы инфильтрации повторяют анатомические границы нескольких сегментов. Часто протекает с уменьшением размеров пораженного участка легкого (ателектатический компонент);
-
лобарная (долевая) — инфильтрация охватывает долю легкого. Вариантом течения долевой пневмонии является крупозная пневмония;
-
интерстициальная — наряду с негомогенными инфильтратами легочной паренхимы имеются выраженные, иногда преобладающие изменения в интерстиции легких. Редкая форма пневмонии, которая развивается у больных с ИДС.
-
-
По течению:
-
острая — длительность до 6 недель;
-
затяжная — длительность более 6 недель.
-
-
По тяжести:
-
средней тяжести;
-
тяжелая.
-
-
По развившимся осложнениям:
2. ЭПИДЕМИОЛОГИЯ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
2.1. Заболеваемость внебольничной пневмонией
С 2011г. ВП включена в перечень инфекционных и паразитарных заболеваний, подлежащих регистрации и государственному учету в Российской Федерации, а статистические показатели заболеваемости вносятся Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека в «Сведения об инфекционных и паразитарных заболеваниях» (до 2010 г. Минздравом РФ представлялись показатели заболеваемости в целом по внебольничной и госпитальной пневмонии). Данные по заболеваемости ВП представлены в таблице. Правила регистрации случаев заболевания ВП представлены в приложении B.
| Показатели | 2011 г. | 2012 г. | 2013 г. | 2014 г. | |
|---|---|---|---|---|---|
У детей в возрасте до 17 лет включительно |
абсолютное число |
139 016 |
168 391 |
190 711 |
181 313 |
на 100 тыс. населения |
534,3 |
642,5 |
722,8 |
678,7 |
|
У детей в возрасте до 15 лет включительно |
абсолютное число |
129 055 |
154 160 |
176 093 |
171 604 |
на 100 тыс. населения |
607,4 |
711,5 |
800,9 |
762,3 |
|
В 2014 г. среди всего населения Российской Федерации из 507 031 случая заболеваний ВП (заболеваемость 354,1 на 100 тыс. населения) на детей и подростков до 17 лет пришлось 181 313 случаев (заболеваемость 678,7 на 100 тыс. населения), из них на детей до 15 лет 171 604 случая (заболеваемость 762,3 на 100 тыс. населения) [4]. Таким образом, заболеваемость ВП среди детей до 15 лет более чем в 2 раза превышает заболеваемость для населения в целом.
Эпидемиологические исследования показывают, что в течение года заболеваемость ВП минимальная в июле–сентябре, повышается в октябре–декабре, достигает максимума в январе–апреле и снижается в мае– июне. Заболеваемость ВП коррелирует с сезонным повышением уровня ОРВИ [5]. Вспышки микоплазменной ВП характерны для закрытых коллективов и отмечаются каждые 3–5 лет [1].
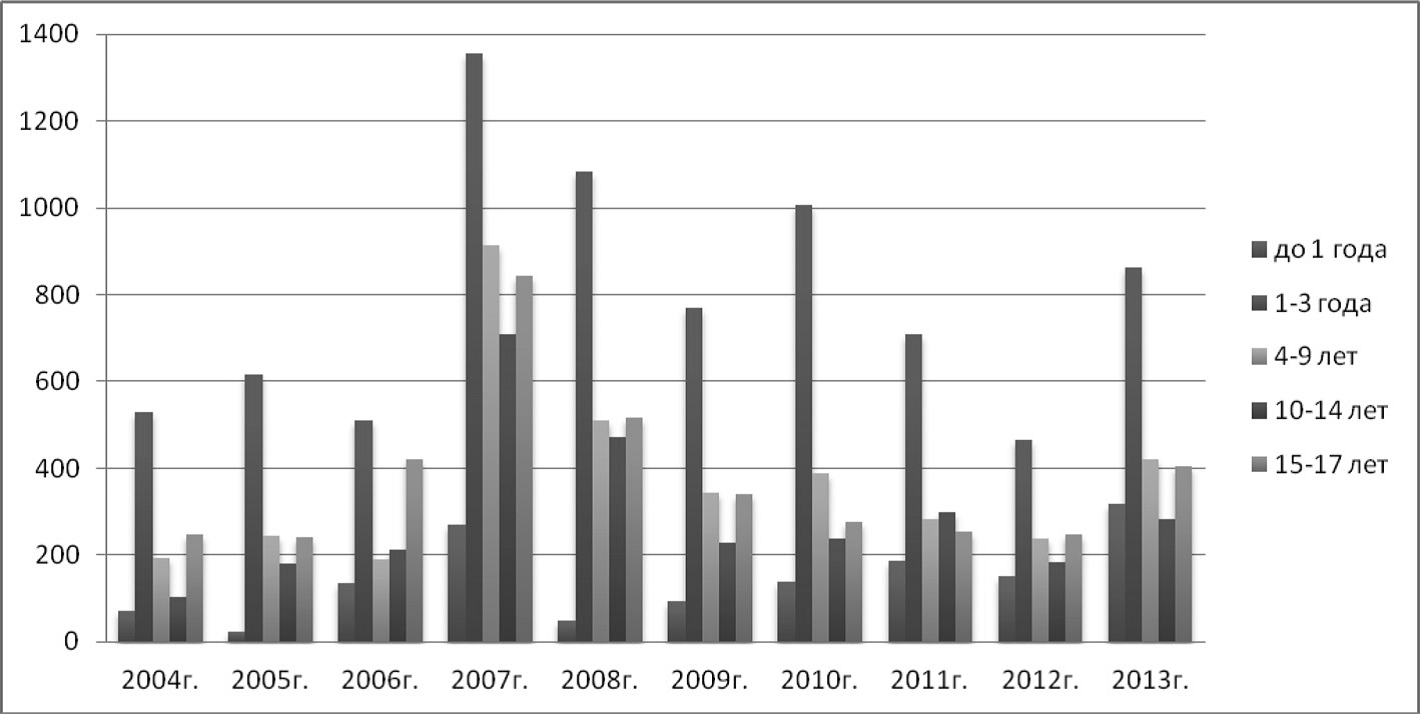
В ряде регионов РФ заболеваемость ВП регистрировалась и до 2010 г. В г. Новокузнецке за 24-летний период наблюдения (1990–2013 гг.) заболеваемость ВП среди детей составляла от 210 до 890 на 100 тыс. населения (2,1–8,9‰), среди подростков — от 140 до 840 на 100 тыс. населения (1,4–8,4‰). Максимальная заболеваемость ВП во все годы наблюдалась у детей в возрасте 1–3 лет — от 465 до 1356 на 100 тыс населения (см.рисунок) [6].
2.2. Смертность от внебольничной пневмонии
По данным ВОЗ пневмония является главной причиной детской смертности во всем мире. Среди причин летальности у детей до 5 лет на ее долю приходится 17,5%, что ежегодно в мире составляет около 1,1 млн смертельных случаев (это больше, чем СПИД, малярия и корь вместе взятые). При этом 99% летальных случаев от пневмонии у детей до 5 лет приходятся на слабо и средне развитые страны мира [7].
В глобальном исследовании было установлено, что в 2010 г. летальность в связи с тяжелыми острыми инфекциями нижних дыхательных путей у госпитализированных детей в возрасте до 5 лет в развивающихся странах была почти в 4 раза выше, чем в развитых (2,3% и 0,6%, соответственно) [8].
По данным Минздрава РФ болезни органов дыхания у детей в возрасте 0–17 лет занимают третье место в структуре причин смерти после внешних причин и пороков развития. В РФ в последние годы произошло значительное снижение смертности от пневмонии детей первого года жизни: с 16,1 в 1995 г. до 2,7 в 2012 г. на 10 000 родившихся живыми (при этом, в 24% пневмония выступает не основной, а конкурирующей причиной смерти больных). Данные о смертности от пневмонии по регионам РФ имеют значительный разброс показателей — от 0 до 13,7 на 10 000 (в 2009г.) [1], [4],[9].
Фоновые факторы риска летального исхода от пневмонии у детей [9]:
-
возраст до 5 лет и мужской пол;
-
врожденные и хронические заболевания;
-
позднее обращение за медицинской помощью;
-
позднее поступление в стационар;
-
гестационный возраст при рождении меньше 28 недель.
3. ЭТИОЛОГИЯ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
3.1. Возбудители внебольничной пневмонии
Этиология ВП зависит от условий, в которых произошло инфицирование, возраста ребенка, предшествующей антибактериальной терапии, наличия сопутствующих заболеваний, таких как ИДС или аспирационный синдром, а также вакцинации против пневмококковой инфекции, гемофильной инфекции, коклюша, гриппа [1], [5], [10], [11], [12]. Представленные в научной литературе данные об этиологии ВП у детей сильно разняться, что может объясняться различными эпидемическими условиями, в которых проводилось исследование, а также его методологией (в частности, могут различаться критерии диагностики пневмонии).
Возбудителями ВП у детей могут быть различные бактерии и вирусы, а в отдельных случаях — грибы и паразиты. В таблице представлена роль различных бактерий в этиологии ВП по данным издания ERS [13].
Бактерии |
Возрастная группа |
|||
Новорожденные |
1–3 мес |
4 мес – 4 года |
5–18 лет |
|
_Streptococcus pneumoniae |
+ |
+++ |
++++ |
+++ |
Haemophilus infl uenzae |
+ |
+ |
+ |
± |
Streptococcus pyogenes |
– |
+ |
+ |
+ |
Staphylococcus aureus |
++ |
++ |
+ |
+ |
Streptococcus agalactiae |
+++ |
+ |
– |
– |
Escherichia coli |
++ |
+ |
– |
– |
Mycoplasma pneumoniae |
– |
+ |
++ |
++++ |
Clamydophyla pneumoniae |
– |
+ |
+ |
++ |
Legionella pneumophila |
+ |
+ |
+ |
+ |
Chlamydia trachomatis |
+ |
++ |
– |
– |
Bordetella pertussis |
± |
++ |
+ |
+ |
++++ очень часто, +++ часто, ++ относительно нечасто, + редко, ± очень редко, — нет.
Вирусы имеют важное значение в этиологии ВП у детей раннего возраста, могут выступать в роли непосредственного возбудителя или играть роль ко-патогена при ВП бактериальной этиологии. В 2009–2013 гг. в разных странах мира было проведено 13 крупных исследований (более 7000 детей), в которых оценивалась этиологическая роль вирусов при ВП. В целом вирусы были выявлены у 41,3% пациентов (от 17,9 до 73,5% в различных исследованиях) [14]. В отдельных исследованиях было показано, что с вирусами связано до 80% случаев ВП у детей до 2 лет [13], [15]. Роль различных вирусов в этиологии ВП у детей представлена в таблице.
| Вирус | Выявление при ВП у детей |
|---|---|
Респираторносинцитиальный |
По данным большинства исследований — самый частый вирусный возбудитель ВП у детей. Выявлен в 2,4–39,4% случаев |
Риновирус человека |
3–100% детей с ВП, чаще в ассоциации с другими вирусами (энтеровирусы и др.) |
Гриппа (А и В) |
2–14,1% |
Парагриппа |
0–17% |
Аденовирус |
0–18% |
Метопневмовирус человека |
0,2–14,5% |
Бокавирус человека |
0–18,4% |
Коронавирус человека |
0,8–6,6% |
Исследования, в которых широко проводилась качественная верификация возбудителей, показывают, что в 23–33% случаев ВП является смешанной вирусно-бактериальной инфекцией [15]. При смешанной вирусно-бактериальной инфекции вирус, очевидно, выступает как фактор, способствующий инфицированию нижних дыхательных путей бактериальной флорой.
S.pneumoniae — самый частый возбудитель ВП у детей [13], [15], [16]. По данным мультицентрового исследования в 18 городах РФ среди серотипов пневмококка (анализ 223 штаммов) чаще всего ВП у детей до 5 лет вызывает серотип 19 (в 33,6% случаев). Также важное значение имеют серотипы 6 (15,8%), 23 (8,9%) и 14 (7,2%). Остальные серотипы пневмококка выделялись менее чем в 5% случаев или не выделялись [17].
Имеются существенные возрастные особенности этиологии ВП. У новорожденных основными возбудителями являются S.agalactiae (β-ге молитический стрептококк группы В), E.coli, S.aureus. Также возбудителем пневмонии в неонатальном периоде может быть L.monocytogenes. ВП, вызванные S.pneumoniae и H. infl uenzae, у новорожденных наблюдается редко. В этиологической структуре ВП у детей 1–3 мес основную роль играют вирусы. В этом возрасте сохраняют значение S.aureus, S.agalactiae (β-гемолитический стрептококк группы В), E.coli, возрастает роль S.pneumoniae. Бактериальные пневмонии в первые месяцы жизни чаще всего развиваются у детей с привычной аспирацией пищи (с рефлюксом и/или дисфагией), а также как первая манифестация муковисцидоза и иммунодефицита [16]. Также в этом возрасте могут отмечаться ВП, вызванные C.trachomatis (инфицирование ребенка происходит во время родов). Этиологическая роль других атипичных бактерий, инфицирование которыми также может происходить во время родов (M.hominis и U.urea lyticum) является спорной [1], [13], [15]].
У детей 3 мес — 5 лет чаще всего ВП вызывает S. pneumoniae (по данным отдельных исследований их доля составляет 70–88% случаев). Из типичных бактерий также определенную роль играет H.infl uenzae типа b (до 10% случаев, преимущественно у детей до 2 лет).
Указанные бактерии обусловливают большинство случаев пневмоний, осложненных легочной деструкцией и плевритом. Пневмонии, вызванные атипичными бактериями в этом возрасте наблюдаются нечасто: на долю M.pneumoniae приходится 9–22%, на долю C. pneum oniae — 4–6% [1], [13], [15]].
В этиологии ВП у детей старше 5 лет сохраняется большое значение S. pneum oniae, на долю которого приходится 35–40% всех случаев. В тоже время возрастает роль атипичных бактерий, особенно в подростковом возрасте: ВП, вызванные M. pneumoniae составляют 18–44% (в отдельных исследованиях более 60%), а C. pneumoniae — 1–30% [1], [13], [15]].
К редким возбудителям ВП относятся B.pertussis, L.pneumophila, M.catarrh alis, K.pneumoniae, S.pyogenes. Необычная этиологию ВП (Candida spp., Aspergillus spp., P.jiroveci) может наблюдаться у больных, получавших иммуносупрессивную терапию или ВИЧ-инфицированных. У больных муковисцидозом ВП может вызывать P.aeruginosa [1]. На фоне ветряной оспы повышается риск пневмонии, вызванной S.pyogenes, на фоне гриппа А — S.aureus [18].
В целом, независимо от тяжести болезни в этиологии ВП у детей доминирует S.рneumoniaе, однако по мере нарастания тяжести увеличивается доля S.aureus, H.infl uenzae, бактерий семейства Enterobacteriaceae и L.рneumophilae, а значение M.pneumoniaе и C.pneumoniaе уменьшается [14]. Согласно данным глобального исследования (данные из 192 стран) большинство случаев смерти от ВП у детей связаны со S.рneumoniaе и H.in fl uenzae [19]
3.2. Резистентность возбудителей внебольничной пневмонии к антибактериальным препаратам
Резистентность возбудителей инфекции к АБП является нарастающей глобальной проблемой. Высокий уровень резистентности и полирезистеность (утрата чувствительности сразу к нескольким АБП) наблюдается в основном у пациентов с хроническими заболеваниями, часто получающих антибиотики, и у детей, находящихся в закрытых коллективах (интернаты, дома ребенка).
В РФ наиболее объемные данные по резистентности клинических штаммов S.pneumoniae были получены в рамках многоцентровых исследований ПеГАС I-III (таблица) [20].
АБП |
ПеГАС I (1999– 2003гг.), n=791 |
ПеГАС II (2004– 2005гг.) n=913 |
ПеГАС III (2006– 2009гг.) n=715 |
||||||
У/Р (%) |
Р (%) |
МПК90 (мг/л) |
У/Р (%) |
Р (%) |
МПК90 (мг/л) |
У/Р (%) |
Р (%) |
МПК90 (мг/л) |
|
Пенициллин |
7,8 |
1,9 |
0,06 |
6,9 |
1,2 |
0,06 |
9,1 |
2,1 |
0,125 |
Амоксициллин |
0 |
0,1 |
0,25 |
0 |
0,3 |
0,06 |
0,4 |
0 |
0,06 |
Амоксициллин/ Клавуланат Амоксициллин/ Сульбактам |
0 |
0 |
0,06 |
0 |
0,3 |
0,06 |
0,4 |
0 |
0,06 |
Цефтриаксон, цефотаксим |
1,4 |
0,4 |
0,03 |
0,9 |
1,1 |
0,06 |
0,4 |
0,6 |
0,06 |
Цефтибутен |
– |
– |
– |
10,5 |
6,9 |
16 |
6,2 |
6,7 |
16 |
Цефиксим |
– |
– |
– |
– |
– |
– |
2,2 |
4,6 |
1 |
Эртапенем |
– |
– |
– |
– |
– |
– |
0 |
0 |
0,06 |
Эритромицин |
0,1 |
8,1 |
0,06 |
0,2 |
6,4 |
0,06 |
1 |
3,6 |
0,03 |
Азитромицин |
0,5 |
7,6 |
0,125 |
0,2 |
6,2 |
0,25 |
0,9 |
6,4 |
0,06 |
Кларитромицин |
0,5 |
7,5 |
0,06 |
0,3 |
6,1 |
0,06 |
1,6 |
5,7 |
0,03 |
Мидекамицин |
0,5 |
3,3 |
0,5 |
0,4 |
3,9 |
0,5 |
1,5 |
4,5 |
0,25 |
Спирамицин |
1 |
1 |
0,5 |
0,9 |
3,6 |
0,25 |
1 |
5,3 |
0,25 |
Джозамицин |
– |
– |
– |
– |
– |
– |
1,5 |
2,5 |
0,5 |
Клиндамицин |
0,1 |
2,8 |
0,06 |
0 |
3,6 |
0,06 |
0,2 |
4,3 |
0,03 |
Ципрофлоксацин |
15,8 |
0,3 |
2 |
11,5 |
0,9 |
2 |
6,4 |
1,4 |
1 |
Левофлоксацин |
0 |
0 |
1 |
0 |
0,1 |
1 |
0 |
0 |
1 |
Моксифлоксацин |
0,3 |
0 |
0,125 |
0,1 |
0 |
0,125 |
0 |
0 |
0,125 |
Гемифлоксацин |
– |
– |
– |
0,1 |
0 |
0,03 |
0 |
0 |
0,015 |
Тетрациклин |
2,4 |
24,9 |
16 |
4,8 |
24,8 |
16 |
3,1 |
21,5 |
16 |
Ко-тримоксазол |
26,3 |
5,4 |
2 |
29,1 |
11,8 |
4 |
22,4 |
16,6 |
4 |
Хлорамфеникол |
0 |
7,7 |
4 |
0 |
5,9 |
2 |
0 |
7,1 |
2 |
Ванкомицин |
0 |
0 |
0,5 |
0 |
0 |
0,5 |
0 |
0 |
0,5 |
Уровень резистентности пневмококков к пенициллину в 2006–2009гг. превысил критическое значение — 10%. Однако, чувствительность к амоксициллину, являющемуся препаратом выбора при пневмококковых инфекциях, сохраняется на очень высоком уровне — 99,6%. Пневмококки лишены способности продуцировать β-лактамазы, а механизм их резистентности к β-лактамным антибиотикам обусловлен модификацией пенициллиносвязывающего белка. В этой связи ИЗАП не имеют преимуществ перед амоксициллином в отношении данного возбудителя. Устойчивость S.pneumoniae к макролидам по данным исследований ПеГАС I-III не превышает 10%. Отсутствует резистентность S.pneumoniae к карбапенемам и ванкомицину, а к респираторным фторхинолонам были резистентны лишь единичные штаммы.
У отдельных категорий населения уровень резистентности может быть существенно выше средних показателей. В российском мультицентровом исследовании у детей до 5 лет, посещающих детские сады, не было случаев носительства PRSP (анализ 143 штаммов пневмококка), тогда как у детей этого возраста из детских домов частота выделения PRSP составила 17,5% (анализ 163 штаммов) [17].
Исследования последних лет свидетельствуют о нарастающей резистентности S.pneumoniae к АБП. Так, в исследовании, проведенном в Москве в 2009–2011 гг. и включавшем анализ 350 госпитальных штаммов (получены от детей в возрасте от 2 мес. до 17 лет), доля PRSP составила 26,8%, частота резистентности к 14-членным макролидам была 20,4% (включая штаммы с промежуточным уровнем резистентности) [21].
Основной проблемой резистентности H.infl uenzae в мире является продукция β-лактамаз, что обуславливает неэффективность аминопенициллинов. В РФ по данным исследования ПеГАС-III, резистентность (включая штаммы с умеренной резистентностью) к амоксициллину среди клинических штаммов H.infl uenzae (n=433) в 2006–2009гг. составила менее 3%. Не было выявлено штаммов, устойчивых к амоксициллину/клавуланату, цефалоспоринам III поколения, фторхинолонам (см. таблицу) [22].
| АБП | У/Р (%) | Р (%) | МПК90 (мг/л) |
|---|---|---|---|
Амоксициллин |
1,6 |
1,2 |
1 |
Амоксициллин/клавуланат |
0 |
0 |
0,5 |
Цефотаксим, цефтриаксон |
0 |
0 |
0,03 |
Цефтибутен |
0 |
0 |
0,125 |
Кларитромицин |
0,5 |
0 |
8 |
Азитромицин |
0 |
0 |
1 |
Левофлоксацин |
0 |
0 |
0,03 |
Моксифлоксацин |
0 |
0 |
0,03 |
Тетрациклин |
0,5 |
3,3 |
0,5 |
Хлорамфеникол |
0,9 |
2,8 |
0,5 |
Ко-тримоксазол |
24,1 |
8,7 |
16 |
4. ПАТОГЕНЕЗ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
Пневмония является инфекционным заболеванием, связанным с проникновением микроорганизмов в легкие. Возникающая при этом воспалительная реакция в паренхиме легких зависит от количества и вирулентности микроорганизмов, состояния защитных механизмов дыхательных путей и организма в целом.
Возбудители могут попасть в легкие несколькими путями, которые для разных микроорганизмов могут различаться (см.таблицу) [10]:
-
аэрогенный (основной) — в результате аспирации секрета носоглотки или вдыхания аэрозоля, содержащего микроорганизмы,
-
лимфогенный и гематогенный (редки и не имеют большого практического значения) — в результате распространение микроорганизма из внелегочного очага инфекции.
| Пути инфицирования | Микроорганизмы |
|---|---|
Аспирация секрета из носоглотки |
S.pneumoniae, H.infl uenzae, грамотрицательные бактерии, анаэробы |
Вдыхание аэрозоля |
M.pneumoniae, C.pneumoniae, L.pneumophila, C.psittaci |
Гематогенное распространение |
S.aureus |
Аспирация содержимого носоглотки — основной механизм инфицирования легких и развития ВП. В нормальных условиях ряд микроорганизмов, в частности S.pneumoniae, могут колонизировать носоглотку, но нижние отделы дыхательных путей при этом остаются стерильными. Микроаспирация секрета носоглотки — феномен, наблюдающийся у половины здоровых лиц, преимущественно во время сна. Однако кашлевой рефлекс, мерцательный эпителий, антибактериальная активность альвеолярных макрофагов и секреторных иммуноглобулинов обеспечивают элиминацию инфицированного секрета из нижних отделов дыхательных путей и их стерильность.
При повреждении механизмов самоочищения трахеобронхиального дерева, например при респираторной вирусной инфекции, когда нарушается функция ресничек эпителия бронхов и снижается фагоцитарная активность альвеолярных макрофагов, создаются благоприятные условия для развития ВП. В отдельных случаях самостоятельным патогенетическим фактором могут быть массивность обсеменения или проникновение в респираторные отделы легких даже единичных высоковирулентных микроорганизмов [3], [10].
Далее при пневмонии любой этиологии происходит фиксация и размножение инфекционного агента в эпителии респираторных бронхиол. Мелкие дыхательные пути не имеют мерцательного эпителия. Они очищаются с помощью сурфактанта и потока выдыхаемого воздуха. Дефекты образования сурфактанта и нарушение бронхиальной проходимости также способствуют развитию пневмонии. Микроорганизм, преодолев защитные барьеры дыхательных путей, способен попасть непосредственно в альвеолы и там интенсивно размножаться. Под действием токсинов микроба нарушается проницаемость капилляров, развивается серозный отек. Отечная жидкость, содержащая большое количество бактерий, может распространяться через альвеолярные поры на всю долю легкого, нередко вовлекая в воспалительный процесс плевру. Экссудат из серозного быстро превращается в фибринозный, пораженная часть легкого становится плотной. Воспалительная реакция вначале может возникать и в бронхах, постепенно распространяться в дистальном направлении, достигая альвеол. В этом случае поражается не вся доля легкого или сегмент, а возникает один или несколько очагов воспаления различных размеров — очаговая (дольковая) пневмония. Очаги могут сливаться в пределах сегмента, доли или нескольких долей. Нарушения проходимости бронхов, расстройства микроциркуляции, воспалительная инфильтрация, интерстициальный отек и снижение воздушности легочной паренхимы приводят к нарушению перфузии газов и гипоксемии; последняя сопровождается респираторным ацидозом, гиперкапнией, компенсаторной одышкой и появлением других клинических признаков дыхательной недостаточности. Пневмония у детей нередко сопровождается не только дыхательной, но и сердечно-сосудистой недостаточностью, возникающей в результате циркуляторных нарушений, перегрузки малого круга кровообращения [5].
В случае формирования адекватного иммунного ответа при инфицировании легочной ткани происходит ограничение распространения воспалительного процесса, в связи с чем пневмония в большинстве случаев имеет одностороннюю локализацию и не выходит за рамки пораженного легкого. У больных с локализованной (односторонней) пневмонией уровни фактора некроза опухоли альфа (TNF-α) и ИЛ-6 и ИЛ-8 оказываются повышенными в пораженном легком, но остаются нормальными в интактном легком и сыворотке крови [10],[11]. В случаях тяжелой пневмонии воспалительный ответ выходит за пределы пораженного легкого, приобретая системный характер. Это, в частности, отражается в повышении уровня указанных провоспалительных медиаторов в сыворотке крови. Гетерогенность ответа на очаговую легочную инфекцию может быть объяснена генетическим полиморфизмом: в настоящее время есть сведения о большом числе генов, оказывающих влияние на течение и исходы пневмонии [12].
5. ДИАГНОСТИКА ПНЕВМОНИИ
5.1. Клинические симптомы
Диагностика ВП на основании клинических симптомов сопряжена с существенными трудностями, в диагностике имеет значение сочетание клинических проявлений (см.таблицу). Так, чувствительность сочетания лихорадки, тахипноэ, локальных ослабления дыхания и мелкопузырчатых влажных хрипов составляет около 94% [24].
Частые симптомы пневмонии |
Лихорадка с ознобом, потеря аппетита, кашель, тахипноэ и/или диспное |
Нечастые симптомы пневмонии |
Боль в грудной клетке и животе, рвота, у детей раннего возраста — нарушение сознания, судороги |
Перкуссия легких |
Локальное укорочение перкуторного звука |
Аускультация легких |
Ослабленное или бронхиальное дыхание, крепитация или мелкопузырчатые влажные хрипы, бронхофония |
Для пневмонии характерно острое начало. Симптомы ВП малоспецифичны — они могут наблюдаться при ОРВИ. Отсутствие лихорадки у ребенка старше 6 месяцев исключает пневмонию. У детей первых месяцев жизни при ВП, вызванных C.trachomatis, температура тела незначительно повышена или нормальная [1], [15], [23]].
Одним из ключевых признаков пневмонии является тахипное и/или диспное. Возрастные критерии тахипноэ у детей до 5 лет представлены в таблице.
| Возраст | Нормальные значения (дыхание в минуту) | Тахипное (дыханий в минуту) |
|---|---|---|
до 2 мес |
30–50 |
≥ 60 |
2—12 мес |
25–40 |
≥ 50 |
1—5 лет |
20–30 |
≥ 40 |
> 5 лет |
15–25 |
≥ 30 |
Характерные физикальные симптомы наблюдаются у 50–70% детей с пневмонией, в тоже время их отсутствие не исключает пневмонии [1], [23].
При ВП миколазменной этиологии часто одновременно наблюдается распространенный бронхит, что проявляется обилием влажных хрипов, обычно асимметричных. Для ВП хламидийной этиологии характерно постепенное начало, нередко одновременно отмечаются воспалительные симптомы со стороны верхних дыхательных путей [23].
5.2. Лабораторные тесты
Изменения в общем анализе крови при ВП зависят от этиологии заболевания:
-
для ВП, вызванной S.pneumoniae и другими типичными бактериями характерен нейтрофильный лейкоцитоз (более 15×109/л) и существенное повышение СОЭ, при этом степень лейкоцитоза коррелирует с риском развития деструкции легких;
-
для ВП микоплазменной, хламидийной и вирусной этиологии — характерных изменений нет, за исключением хламидийной пневмонии у детей первых месяцев жизни, при которой может наблюдаться высокий лейкоцитоз (более 30×109/л).
В целом изменения в общем анализе крови при ВП обладают низкой диагностической ценностью как для постановки диагноза, так и для уточнения этиологии заболевания [13], [15], [16], [23].
Значительное повышение в крови уровня СРБ и других белков острой фазы воспаления, а также цитокинов (ИЛ-1 и ИЛ-6) характерно для тяжелой пневмонии бактериальной этиологии. Определение СРБ в динамике может быть использовано для оценки эффективности терапии [13], [15], [16], [23]]. Исследования последних лет свидетельствуют о большом значении определения уровня ПКТ крови при пневмонии:
-
уровень показателя существенно зависит от этиологии заболевания и может быть полезен при выборе терапии — для бактериальной пневмонии характерно повышение более 1 нг/мл (при пневмококковой обычно выше 2 нг/мл), при вирусной пневмонии, как правило, ниже 1 нг/мл;
-
уровень ПКТ, как правило, коррелирует с тяжестью заболевания, является предиктором развития осложнений и неблагоприятного исхода, в связи с чем, может использоваться как один из критериев для перевода пациента в ОРИТ;
-
показатель быстро нормализуется на фоне адекватной АБТ и может использоваться в качестве объективного индикатора ее отмены [13].
У пациентов с рекуррентным или необычно тяжелым и/или длительным течением ВП, а также в случае выявления нетипичных возбудителей заболевания необходимо исключение ВИЧ-инфекции и определение иммунного статуса: тестов I уровня (определение концентрации сывороточных иммуноглобулинов), а по показаниям — тестов II уровня (исследование фагоцитарной функции и системы комплемента, Т-системы и B-системы иммунитета).
5.3. Инструментальные исследования
Рентгенография грудной клетки — надежный метод для своевременного подтверждения диагноза пневмонии, который также позволяет определить объем поражения и наличие осложнений. При пневмонии выявляется инфильтрация легочной ткани. Изменения на рентгенограмме не позволяют судить об этиологии ВП. В тоже время, при выборе эмпирической АБТ нужно учитывать, что для пневмококковой пневмонии более характерна гомогенная тень с четкими границами, а для микоплазменной — негомогенная, без четких границ [10], [23].
В редких случаях, обычно у определенных контингентов пациентов, могут наблюдаться ложноотрицательные результаты рентгенологической диагностики пневмонии, которые могут быть обусловлены обезвоживанием, нейтропенией, пневмоцистной этиологией или ранней стадией заболевания. В этих случаях необходимо повторить рентгенограмму или выполнить КТ легких [10]. Проведение КТ легких также рекомендуется при развитии осложнений ВП [13].
Контрольная рентгенография показана при ВП только в случае отсутствии эффекта от лечения и развития осложнений [23].
Применение УЗИ рекомендуется для контроля за течением плеврита, что позволяет уменьшить лучевую нагрузку [23].
Пульсоксиметрия — неинвазивный метод измерения насыщения артериальной крови кислородом, который рекомендуется провести у всех пациентов с ВП для объективной оценки тяжести заболевания и решения вопроса об объеме лечебных мероприятий [15], [16].
При ВП с признаками бронхообструктивного синдрома целесообразно использование функциональных методов оценки внешнего дыхания: спирография и/или бронхофонография с бронхолитическим тестом (приложение C).
5.4. Исследования для определения этиологии внебольничной пневмонии
Современные возможности и ограничения этиологической диагностики пневмонии представлены в таблице.
Применение микробиологической диагностики при ВП ограничено объективными причинами, поэтому в амбулаторных условиях она практически не проводится. В современных зарубежных руководствах по ВП у детей не рекомендуют проведение микробиологической диагностики у пациентов, не требующих госпитализации [15], [16].
Существенным затруднением в определении этиологической роли основных пневмотропных микроорганизмов является их принадлежность к условно-патогенным микроорганизмам, колонизирующим слизистую оболочку верхних дыхательных путей [25].
Бактериологический анализ крови (гемокультута) целесообразно проводить у госпитализированных детей с тяжелой ВП, особенно в случае развития осложнений, а также в случае неэффективности АБТ [15], [16].
При пневмококковой бактериемии в случае улучшения состояния на фоне АБТ повторное исследование гемокультуры не целесообразно, при выявлении в крови S.aureus рекомендуется повторный анализ, независимо от результатов лечения [16].
| Метод исследования | Сроки проведения | Ограничения | Чувствительность (%) | Специфичность (%) |
|---|---|---|---|---|
Бактериоскопия мазка мокроты, окрашенного по Граму (с учетом цитологических критериев) |
Любые в амбулаторных условиях, первые 3 дня пребывания в стационаре |
Нет |
50–60 |
80 |
Бактериоскопия мазка плеврального экссудата, окрашенного по Граму |
При плевральной пункции |
Нет |
50–60 |
80 |
Гемокультура |
Первые 3 дня заболевания |
АБТ |
2–18 |
> 95 |
Культура мокроты |
29–94 |
50 |
||
Культура БАЛ |
90 |
97 |
||
Культура плеврального экссудата |
При плевральной пункции |
АБТ |
40–70 |
100 |
ПЦР кровь |
Любые в амбулаторных условиях, первые 3 дня пребывания в стационаре |
Нет |
100 |
95–99 |
ПЦР мокрота |
Некачественно собранный образец |
80–90 |
> 85 |
|
ПЦР БАЛ |
86–100 |
90–100 |
||
ПЦР секрет носо- или ротоглотки |
56–73 |
99 |
||
ПЦР плевральная жидкость |
При плевральной пункции |
Нет |
68–100 |
92–100 |
Серодиагностика |
После 7 дня (первая сыворотка) и спустя 10–14 дней (вторая сыворотка) |
Отсутствие парных сывороток |
80 |
92 |
Выявление АГ антигенов в плевральном экссудате |
При плевральной пункции |
АБТ |
< 70 |
> 90 |
Выявление АГ пневмококка в моче |
У детей не используется |
Возраст до 17 лет |
71–96 |
50–60 |
Выявление АГ легионелл в моче |
Любые |
Нет |
83 |
100 |
Бактериоскопия мазка мокроты окрашенного по Граму и исследование культуры мокроты рекомендуется проводить у госпитализированных детей во всех случаях отделения мокроты. До посева в лаборатории исследуется мазок доставленного материала, окрашенный по Граму. Метод бактериоскопии является обязательным методом экспресс-диагностики. С учетом цитологических критериев он обладает чувствительностью 50–60% и специфичностью — 80%. Неинформативные образцы (≥ 10 клеток плоского эпителия и ≤ 25 сегментоядерных нейтрофилов при низком разрешении — ×100) не подлежат бактериологическому исследованию: исследуемый образец представляет собой содержимое ротовой полости или носоглотки. При гнойном характере мокроты окраска по Граму позволяет поставить предварительный этиологический диагноз в 80% случаев [26].
В идентификации причинно-значимого возбудителя имеют значение не только методы, исследуемый материал и качество расходных материалов, но и соблюдение правил взятия материала на исследование, хранения и доставки его в лабораторию (приложение D и приложение E).
Классический бактериологический анализ мокроты является основным методом диагностики. Чувствительность и специфичность метода составляет около 50%. Существенный недостаток — позднее получение результатов (через 3–4 суток от забора материала).
Бактериологический анализ мазков из носо- и ротоглотки для этиологической диагностики ВП малоинформативен из-за значительного числа как ложно-положительных, так и ложно-отрицательных результатов. Для идентификации бактерий выделенных в чистой культуре большие перспективы имеют спектральные методы изучения целых бактериальных клеток и их основных компонентов. Разработана простая и точная технология масс-спектрометрической идентификации любых видов микроорганизмов и грибов в течение нескольких минут (MALDI-TOF MS). Каждый полученный образец плеврального экссудата рекомендуется направлять на бактериологический анализ (бактериоскопия мазка, окрашенного по Граму и культуральное исследование). Также целесообразно проведение ПЦР-диагностики и определение антигенов пневмококка в плевральной жидкости [15], [16].
Оценка результатов бактериологического исследования: диагностическое значение имеет обнаружение пневмотропных бактерий в количестве — lg6 в мокроте или lg4 в БАЛ. Достоверным является высев возбудителя из крови и плеврального экссудата, которые в норме стерильны. Бактериологические исследования крови, мокроты, плеврального экссудата необходимо проводить до начала АБТ.
Иммунологические методы диагностики направлены на обнаружение бактериального антигена и/или антител возбудителя. Метод латекс-агглютинации (чувствительность до 70%, специфичность — более 90%.) применяют для обнаружения пневмококкового антигена в плевральной жидкости, а также для серологического типирования выделенных из биоматериала штаммов микроорганизмов. Иммуноферментный анализ (ИФА) применяется преимущественно при оценке нарастания титров АТ к вирусам и для выявления острофазовых специфических АТ к атипичным возбудителям. Исследование нецелесообразно широко использовать в клинической практике для выявления специфического иммунного ответа при пневмонии, в связи с ранней выпиской пациентов (до 10–14 дня). Иммунохроматографический анализ (ИХА) применяется для выявления АГ гемолитического стрептококка групп А и В, MRSA, вирусов.
Методы ПЦР позволяют выявлять и идентифицировать бактерий без выделения чистых культур, характеризуются высокой диагностической точностью и особенно актуальны для выявления атипичных бактерий (М. pneu moniae, C. pneumoniae, Legionella spp.) и респираторных вирусов. Для анализа используются мазки со слизистых оболочек, трахеальный аспират, мокрота, кровь [15], [16], [24]. Исследование мокроты или трахеального аспирата предпочтительно — положительный результат ПЦР на один из атипичных возбудителей позволяет считать этиологию установленной. При невозможности получить мокроту или трахеальный аспират допустимо исследовать мазок из носо- и ротоглотки, однако положительный результат позволяет считать этиологию пневмонии лишь предположительно. Отрицательный результат ПЦР при исследовании мазков следует трактовать с осторожностью, особенно, при длительности заболевания более 2–х недель на момент обследования [28].
Недостаток ПЦР — невозможность отличить живого возбудителя от погибшего, что может приводить к ошибкам в интерпретации положительных результатов ПЦР при контроле эффективности лечения больного. Одновременное определение микоплазменной и хламидийной инфекции на основании выявления антител класса IgM (методом ИФА) и положительного результата ПЦР повышает надежность диагностики атипичных возбудителей инфекций и позволяют более точно определить возбудителя в случае серопозитивных вариантов одновременно на M.pneumoniae и С.pneumoniae [28].
Проведение тестов для выявления антигенов пневмококка в моче у детей не рекомендуется для диагностики пневмонии в связи с высокой частотой ложно-положительных результатов, что объясняется высоким уровнем носоглоточного носительства S.pneumoniae [16].
При тяжелой ВП в случае отсутствии ожидаемого ответа на АБТ оправдано применение всех доступных методов этиологической диагностики (культуральные методы, ПЦР, серологические исследования).
5.5. Критерии диагноза внебольничной пневмонии
Согласно рекомендациям ВОЗ, в условиях с ограниченными ресурсами, у детей в возрасте до 5 лет с кашлем или затруднением дыхания, диагноз пневмонии ставится при наличии тахипноэ или втяжения грудной клетки при вдохе [7]. Современные зарубежные руководства, основываясь на результатах клинических исследований, не рекомендуют проведение рентгенографии грудной клетки у детей с подозрением на ВП, если их состояние не требует госпитализации [15], [16]. Утвержденный в 2012 г. Минздравом РФ «Стандарт первичной медико-санитарной помощи при пневмонии», разработанный для амбулаторных условий, также не предусматривает проведение рентгенографии грудной клетки у всех пациентов [29].
Однако, необходимо учитывать, что у 30–35% больных имеет место поздняя диагностика ВП — только спустя 3–5 дней, что вероятно связано с незначительной выраженностью и неспецифичностью начальных клинических проявлений заболевания. В связи с этим, российские эксперты считают целесообразным проведение рентгенографии грудной клетки у всех детей с подозрением на пневмонию [1].
Диагноз ВП может быть достоверным или вероятным.
Достоверный — выявление на рентгенограмме грудной клетки инфильтрации легочной ткани и наличие не менее 2 из нижеследующих критериев:
-
лихорадка выше 38 °С в течение 3 и более суток;
-
кашель с мокротой;
-
физикальные симптомы пневмонии;
-
лейкоцитоз > 15×109/л и/или число палочкоядерных нейтрофилов > 10%.
Вероятный — наличие лихорадки, кашля и локальных физикальных симптомов пневмонии, но не проведена рентгенография грудной клетки [1].
5.6. Оценка тяжести внебольничной пневмонии
Оценка тяжести ВП у детей необходима для решения вопроса о госпитализации и определения необходимого объема медицинской помощи. Тяжелое течение пневмонии обуславливают выраженность токсикоза, дыхательной недостаточности и наличие осложнений [13], [23].
Оценка тяжести ВП должна учитывать общую клиническую картину заболевания. В таблице представлены ключевые критерии для оценки тяжести ВП у детей в зависимости от возраста, предлагаемые в монографии ERS [13].
Симптомы |
Дети до 1 года |
Дети старше 1 года |
||
Средней тяжести |
Тяжелая |
Средней тяжести |
Тяжелая |
|
Лихорадка, С |
< 38,5 |
≥ 38,5 |
< 38,5 |
≥ 38,5 |
Частота дыханий в мин |
≤ 70 |
> 70 |
≤ 50 |
> 50 |
SaO2 (при вдыхании атмосферного воздуха), % |
≥ 94 |
≤ 93 |
≥ 94 |
≤ 93 |
Втяжение уступчивых мест грудной клетки |
Легкое |
Умеренное или выраженное |
||
Диспноэ |
Раздувание крыльев носа, периодическое апноэ, кряхтящее дыхание |
Легкая одышка |
Выраженное затруднение, раздувание крыльев носа, кряхтящее дыхание |
|
Другие симптомы |
Питание не нарушено |
Цианоз, отказ от еды |
Цианоз, признаки обезвоживания |
|
У госпитализированных пациентов оценка тяжести необходима для решения вопроса о необходимости перевода в ОРИТ. Выделяют 2 основных показания для перевода детей с ВП в ОРИТ [15]:
-
Тяжелая дыхательная недостаточность, требующая вспомогательной или искусственной вентиляции легких.
-
Пневмония с бактериемией (сепсис).
Ключевыми клиническими признаками указанных состояний являются:
-
SaO2 < 92% на фоне оксигентерапии с содержанием кислорода более 60%;
-
признаки шока;
-
прогрессирующее нарастание частоты дыхания и пульса;
-
рецидивирующее апноэ или редкое прерывистое дыхание.
6. ТЕЧЕНИЕ И ОСЛОЖНЕНИЯ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
6.1. Течение внебольничной пневмонии
В первые дни заболевания симптомы при неосложненной и осложненной пневмонии идентичны. У большинства больных наблюдается неосложненная ВП, которая характеризуется гладким течением: нормализация температуры тела происходит обычно в первые двух суток после начала АБТ, исчезновение физикальных симптомов — в течение 7 дней, рентгенологическое разрешение обычно наступает через 2–3 недели (максимально — до 6 недель).
В случае развития осложнений пневмонии чаще наблюдаются продолжительная лихорадка (более 5 дней), даже в случае смены АБП через 48 часов от начала лечения, интенсивное укорочение перкуторного звука, бронхиальное дыхание, отсутствие хрипов в зоне поражения. Осложненная пневмония развивается преимущественно у детей раннего возраста (более 80% случаев).
6.2. Плеврит
Синпневмонический и (или) метапневмонический плеврит является самым частым осложнение при ВП у детей — на его долю приходится около 83% случаев, из них у 30% пациентов он является единственным осложнением, а у 53% — предшествует острой легочной деструкции [30].
Синпневмонический плеврит чаще развивается в первые 5 дней пневмонии. При ВП может быть связан с практически любыми типичными бактериями, в редких случаях — с М.pneumoniae и аденовирусом [23]. На его развитие указывает сохраняющаяся лихорадка, несмотря на адекватную АБТ. В зависимости от возбудителя он может быть фибринозным, серозно-фибринозным и гнойным. Диагностика — рентгеновское исследование и УЗИ.
Метапневмонический (иммуноопосредованный) плеврит чаще всего связан с определенными серотипами S.pneumoniae, реже с H. infl uenzae типа b. Характерен рецидив лихорадки после 1–2 дней нормальной температуры тела или ее сохранение на фоне адекватной АБТ. Высокая лихорадка сохраняется на протяжении 5–10 дней и рефрактерна к проводимой терапии. При рентгенографии определяются признаки серозно-фибринозного плеврита (обычно после седьмого дня болезни). Характерны лейкоцитоз > 15×109/л с постепенным снижением и ускоренное СОЭ > 40 мм/ч, которое сохраняется длительно. Часто развивается вместе с деструктивным изменениям в легочной ткани [23].
6.3. Деструкция легких
Факторами риска развития деструкции легких являются: лобарный инфильтрат, синпневмонический плеврит, ранний возраст и начало АБТ спустя 3 суток от начала заболевания [30].
Внутрилегочные деструктивные процессы с образованием булл или абсцессов возникают на месте массивных очагово-сливных инфильтратов в легких. Наиболее часто эти осложнения вызывают серотипы пневмококка 1, 3, 9 и 14, а также S. aureus, H. infl uenzae типа b, S.pyogenes, K.pneumoniae, P.aeruginosa [1], [12].
Буллы (полостные образования) чаще появляются в период разрешения пневмонии, обычно при удовлетворительном состоянии больного и через 1–4 недели спонтанно исчезают, реже развивается пневмоторакс. Развитие абсцесса легких сопровождается высокой лихорадкой, сохраняющейся свыше 5 суток, серым оттенком кожи, кряхтящим и стонущим дыханием, лейкоцитозом (> 15,0×109/л) и повышенной СОЭ. При рентгенографии определяется «застывший» инфильтрат [23], [30].
Пиопневмоторакс обычно развивается на 7–15-й день заболевания в результате прорыва абсцесса или буллы в полость в плевры. Пиопневмоторакс характеризуется особой тяжестью в связи с развитием синдрома внутригрудного напряжения. Характерны цианоз носогубного треугольника, поверхностное дыхание с тахипноэ, выраженное снижение дыхательных экскурсий на стороне поражения. Перкуторно в средних и верхних отделах на стороне поражения определяется тимпанит, в нижних отделах — укорочение перкуторного звука. При рентгенографии в плевральной полости определяется значительное количество воздуха и уровень жидкости, коллабирующие легкое и смещающие средостение в противоположную сторону [23], [30].
6.4. Инфекционно-токсический шок
Бактериемия с развитием инфекционно-токсического (бактериального) шока — наиболее грозное осложнение при ВП с высоким риском летальности. Наблюдается менее чем у 1% пациентов, обычно при лобарном или большем объеме поражения легких. Клинически проявляется симптомами ОРДС:
-
расстройство гемодинамики — гипотония, холодные конечности, мраморность кожи, акроцианоз, снижение диуреза;
-
некорригируемый при оксигенотерапии цианоз cлизистых оболочек;
-
тахипноэ;
-
SaO2 < 92% или индекс оксигенации (PaO2/FiO2) < 250;
-
нарушение сознания;
6.5. Особенности течения пневмонии у пациентов с детским церебральным параличом
Частота заболеваемости пневмоний у детей с ДЦП достигает 69%. Дети с тяжелым течением ДЦП часто погибают в первые 2 года жизни, при этом самой частой причиной неблагоприятного исходя является пневмония [32].
Для ДЦП характерно псевдопрогредиентное течение (нарушения становятся более явными по мере роста и развития ребенка). Ведущим этиологическим фактором является гипоксия, наиболее тяжелые формы реализуются при сочетании инфекционного–травматического и инфекционно–метаболического поражения ЦНС. Двигательные нарушения при ДЦП часто сопровождаются расстройством чувствительности, зрительного восприятия, когнитивных, коммуникационных и поведенческих функций, эпилепсией и вторичными нарушениями со стороны опорно-двигательной системы (AACPDM, 2007) [31].
При ДЦП важную роль играют также вторичные соматические нарушения (со стороны респираторной, пищеварительной, мочевой систем), что предопределяет сложности абилитации этих детей и уровень выживаемости пациентов.
У пациентов с ДЦП имеются следующие нарушения бронхолегочной системы:
-
Недостаточность эффективного вдоха и выдоха вследствие нарушения иннервации мышц и их атрофии.
-
Снижение ЖЕЛ в связи с изменениями грудной клетки (сколиоз, кефосколиоз и т. д.).
-
Неэффективность кашлевого рефлекса, нарушение баланса между продукцией и резорбцией мокроты, дискинетические изменения в бронхах.
-
Снижение иммунитета и склонность к хронизации инфекции, частые интеркуррентные инфекции.
-
Застойные проявления в легких из-за ограничения объема движений.
-
Высокий риск аспирационных пневмоний, вследствие частого нарушения процесса глотания.
-
Нарушение мукоцилиарного клиренса может способствовать развитию ателектазов, что приводит к вентиляционной перфузии дыхательной мышцы и дыхательной недостаточности [32].
Особенности течения пневмоний у детей с детским церебральным параличом обусловлены:
-
снижением жизненной емкости легких из-за мышечной слабости или спастического сколиоза;
-
ослаблением кашлевого рефлекса;
-
частой дисфагией и рвотой с развитием аспирации;
-
гастроэозофагальной рефлюксной болезнью;
-
тяжелой белково-энергетической недостаточностью с проявлениями кахексии;
-
частой антибиотикорезистентностью возбудителей;
-
быстрым развитием метаболического ацидоза и гиперкапнии;
-
развитием судорог — как истинных, так и фебрильных [31].
У детей с ДЦП преобладает тяжелое течение пневмонии, характерно наличие длительной (до 10 дней), стойкой и труднокупируемой высокой лихорадки. Обычно развивается правосторонняя пневмония (чаще при правостороннем гемипарезе). Чем более выражены признаки поражения ствола мозга и верхних отделов спинного мозга, тем тяжелее и продолжительнее пневмония с формированием участков как гипервентиляции, так и ателектазов, легочного фиброза [32]. При поражении инспираторных мышц (диафрагма, межреберные и добавочные мышцы) развивается гиповентиляция с гипоксией и гиперкапнией [33].
Особенности лечения пневмонии у детей с ДЦП представлены в пункте 7.6.
6.6. Особенности течения пневмонии у ВИЧ-инфицированных пациентов
Частота ВП у больных c ВИЧ-инфекцией выше, чем у здоровых. Этиология ВП зависит от стадии ВИЧ-инфекции. Основными возбудителями пневмоний у ВИЧ-инфицированных детей без СПИД являются S. pneumoniae, H. infl uenzae и S. aureus. При ВИЧ-инфекции ключевое значение имеет выключение Т-хелперов (лимфоциты СD4+) из иммунного ответа или уменьшение их роли, что приводит к нарушениям всех звеньев иммунитета и повышенной восприимчивости к инфекционным заболеваниям, в частности, к инфекциям нижних дыхательных путей. На стадии СПИД общее число лимфоцитов обычно меньше 1000 в мкл, а соотношения CD4/CD8 ниже 1,0 (в норме 1,9–2,4).
Рентгенологическая картина ВП не отличается от обнаруживаемой у неинфицированных ВИЧ. На стадии СПИД доминируют оппортунистические инфекции нижних дыхательных путей: туберкулез и микобактериоз, грибковые поражения (пневмоцистная пневмония, кандидоз, аспергиллез, криптококкоз, гистоплазмоз), вирусные поражения (инфекция вируса простого герпеса, цитомегаловирусная инфекция и др.). Риск оппортунистических инфекций возрастает обратно пропорционально уровню лимфоцитов CD4+: при их количестве в крови менее 200 клеток/мкл причинами поражения легких является туберкулез (41,5%), бактериальные пневмонии (28,6%) и пневмоцистная пневмония (14,3%) [34], [35].
Для оппортунистических пневмоний характерно:
-
повышение температуры до субфебрильных и фебрильных цифр;
-
одышка, цианоз, приступообразный кашель, может быть кровохарканье, боли в грудной клетке;
-
наличие орофарингита, трахеобронхита с выраженным бронхообструктивным синдромом;
-
повышение СОЭ до 40–60 мм/час;
-
значительное повышение уровня лактатдегидрогеназы (ЛДГ);
-
при рентгенологическом исследовании в большинстве случаев определяются достаточно симметричная, незначительная или умеренно выраженная сетчатая перестройка легочного рисунка или диффузное сетчато-узелковое поражение. По мере прогрессирования заболевания отдельные тени сливаются, образуя двусторонние гомогенные затемнения по типу «матового стекл а» в нижних частях обоих легких (в 5–10% случаев рентгенограмма может оставаться нормальной) [36], [37].
С целью ранней дифференциальной диагностики ВП бактериальной природы от инфекций нижних дыхательных путей другой этиологии (вирусной, грибковой) и выбора адекватной стартовой противоинфекционной терапии рекомендуется исследование уровня СРБ и ПКТ крови. Их повышение является наиболее объективным маркером тяжелой бактериальной пневмонии, а сохраняющиеся повышенные показатели являются предиктором неэффективности лечения [3], [38]].
У пациентов с ВИЧ-инфекцией на стадии СПИД целесообразно следующее микробиологическое обследование: бактериоскопия по Граму, бактериоскопия на кислотоустойчивые бактерии, посев мокроты для выделения культур грибов, бактерий и микобактерий (типичных и атипичных), посев крови (бактериемия у ВИЧ-инфицированных наблюдается намного чаще, чем у больных без нарушения иммунитета — в 25–60% случаев). При отсутствии клинического улучшения после начала АБТ в зависимости от клинической и рентгенологической картины определяются антитела к M.pneumoniae и C.рneumoniae в крови, антиген L.рneumophila и гистоплазм в моче, сывороточный криптококковый антиген, сверхранний антиген ЦМВ (pp65) в крови. При безуспешности попыток определить возбудитель пневмонии и отсутствии эффекта от эмпирической терапии, особенно у больных с уровнем лимфоцитов CD4+ менее 200 клеток/мкл показано проведение бронхоскопии с БАЛ и биопсией, после чего проводится выявление возбудителя, его АГ и ДНК в лаважной жидкости методом ПЦР и посев на специаль ные среды для медленнорастущих возбудителей (в частности Nocardia spp.) [36].
Вопросы специфической профилактики инфекций нижних дыхательных путей у пациентов с ВИЧ-инфекцией представлены в пункте 8.2
6.7. Особенности течения пневмонии при муковисцидозе
Муковисцидоз или кистофиброз поджелудочной железы — частое моногенное жизнеугрожающе заболевание (в РФ — 1:10000), ассоциированное с мутациями гена CFTR (ABCC7), характеризующееся поражением экзокринных желез жизненно важных органов и систем, клиническим полиморфизмом и имеющее тяжелое течение и прогноз [38].
В соответствии с МКБ выделяют различные формы муковисцидоза:
-
муковисцидоз с кишечными проявлениями (Е84.1);
-
муковисцидоз комбинированная форма (Е84.8);
-
муковисцидоз неуточненная форма (Е84.9).
-
В первые годы жизни у больных МВ доминируют S.aureus (до 58,4% по данным регистра 2011 г. в общей группе больных)) и H.infl uenzae (до 58% в дошкольном возрасте), а затем основным возбудителем становится P.aeruginosa (32,2%).
-
У больных муковисцидоз имеет место хроническая легочная инфекция: P.aeruginosa — ведущий патоген. При наличии данного возбудителя без проведения профилактических курсов ингаляционной антибактериальной терапии у 50% наблюдаются эпизоды обострения бронхолегочного процесса, 37% больных нуждаются в госпитализации и во внутривенной терапии.
-
В 2/3 случаев хроническая инфекция вызвана ассоциацией микроорганизмов. Cущественный вклад вносят Burkholderia cepacia, Nontuberculous mycobacteria, неферментирующих грамотрицательных микроорганизмов Stenotrophomonas maltophilia, Аchromobacter (Alcaligenes) xylosoxidans, Аspergillus sp. и др.
-
Пневмококковая инфекция нижних дыхательных путей у больных с муковисцидозом встречается редко, но характеризуется тяжелым течением.
Особенности лечения пневмонии у детей с муковисцидозом представлены в пункте 7.7
7. ЛЕЧЕНИЕ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
7.1. Общие рекомендации по ведению пациентов
В подавляющем большинстве случаев (около 80%) дети с ВП могут эффективно лечиться в домашних условиях [41], то есть в условиях медицинской организации 1го уровня, когда — первичная медико-санитарная помощь оказывается в амбулаторных условиях и в условиях дневного стационара врачом-педиатром участковым или врачом общей практики (семейным врачом). При наличии показаний больного направляют к врачу-пульмонологу для оказания первичной специализированной медико-санитарной помощи [42].
Режим больного c ВП — постельный с расширением после нормализации температуры тела. При быстром эффекте лечения перевод на общий режим допустим уже на 6–10 день болезни [23].
При невозможности оказания медицинской помощи в рамках первичной медико-санитарной помощи и наличии медицинских показаний дети с ВП направляются в медицинскую организацию 2го уровня медицинской помощи — стационар, оказывающий специализированную медицинскую помощь по профилю «пульмонология» или «педиатрия».
Показаниями для госпитализации являются:
-
возраст до 6 месяцев жизни;
-
тяжелая пневмония таблица);
-
наличие тяжелых фоновых заболеваний — врожденный порок сердца, хронические заболевания легких, сопровождающиеся инфекцией (бронхолегочная дисплазия, муковисцидоз, бронхоэктатическая болезнь и др.), иммунодефицит, сахарный диабет;
-
проведение иммуносупрессивной терапии;
-
отсутствие условий для лечения на дому или гарантий выполнения рекомендаций — социально неблагополучная семья, плохие социально-бытовые условия (общежитие, дом ребенка, пункт временного размещения и др.);
-
отсутствие ответа на стартовую АБТ в течение 48 ч (сохранение высокой лихорадки, нарастание дыхательной недостаточности, появление возбуждения или угнетения сознания) [15], [23], [41].
Госпитализированных детей с ВП, не требующих интенсивной терапии, предпочтительно изолировать [41]. В стационаре лечение детей ВП осуществляют педиатр и/или пульмонолог, а в ОРИТ — также анестезиолог-реаниматолог, при необходимости — осмотр фтизиатром, торакальным хирургом, физиотерапевтом и врачом лечебной физкультуры. Всем детям с тяжелой ВП (если лечение проводит педиатр) должна быть проведена консультация пульмонолога [43]. При неосложненной ВП и наличии условий для лечения на дому целесообразна ранняя выписка из стационара — сразу после достижении клинического эффекта (на 3–4 день госпитализации), что позволяет снизить риск нозокомиальных инфекций. Сохранение отдельных симптомов заболевания, изменений в анализе крови и на рентгенограмме не являются препятствием для ранней выписки [23].
Дети, перенесшие среднетяжелую ВП, подлежат диспансерному наблюдению в течение 6 мес, а перенесшие тяжелую и осложненную ВП — в течение 12 месяцев в медицинских организациях I уровня врачом-педиатром участковым или врачом общей практики (семейным врачом) по месту жительства, по показаниям — пульмонологом [44]. Дети, перенесшие ВП, могут быть направлены для реабилитации в специализированный местный санаторий. Оптимальным является перевод ребенка в санаторий на 10–11 день стационарного лечения. При этом средняя длительность пребывания на реабилитационном лечении должна составлять не менее 14 дней, в течение которых проводится физиотерапия, лечебная физкультура, рефлексотерапия, мануальная терапия, психотерапия, с учетом подтвержденной результатами обследования перспективы восстановления функций (реабилитационного потенциала) [45]. Плановая вакцинация проводится после выздоровления. Возобновление закаливания возможно через 2–3 нед после нормализации температуры, занятия спортом допустимы через 6–12 нед после выздоровления (в зависимости от тяжести пневмонии) [23].
7.2. Антибактериальная терапия
АБТ оказывает решающее влияние на прогноз пневмонии, поэтому при достоверном диагнозе или у больного в тяжелом состоянием с вероятным диагнозом ее следует начать незамедлительно [1], [23].
Выбор АБТ в каждом случае ВП проводится индивидуально с учетом природной активности препаратов в отношении возбудителя и их возможной приобретенной резистентности, тяжести и течения заболевания, наличия у пациента противопоказаний к использованию тех или иных антибиотиков.
Принцип выбора АБТ в зависимости от возбудителя ВП представлен в таблице. Однако, в реальной клинической практике, особенно в амбулаторных условиях, чаще проводится эмпирическая АБТ.
Принципы эмпирической терапии: раннее назначение АБП с учетом наиболее вероятного возбудителя и его чувствительности в регионе, возраста больного, наличие фоновых заболеваний, токсичность и переносимость АБП для конкретного пациента.
Проведенные доказательные исследования показали, что применение амоксициллина перорально даже при тяжелой неосложненной ВП у детей в возрасте от 3 мес до 5 лет не уступает по эффективности бензилпенициллину или ампициллину, введенному внутривенно [15], [48]]. В связи с этим у всех детей с ВП не имеющих показаний к госпитализации, а также у госпитализированных детей со среднетяжелой ВП целесообразно использование пероральной АБТ. При тяжелой внебольничной пневмонии АБП назначается парентерально или в виде ступенчатой терапии (в два этапа- парентеральное введение 2–3 дня с последующим переходом на пероральное введение АБП).
У детей в возрасте старше 3 мес основным АБП для лечения ВП является амоксициллин (в стандартной дозе — 45–50 мг/кг в сутки), поскольку данный антибиотик обладает высокой стабильной активностью в отношении самого частого и опасного возбудителя — S.pneumoniae, а также в большинстве случаев активен в отношении H.infl uenzae [13], [15], [16], [23].
При выборе лекарственной формы следует учитывать, что диспергируемая таблетка (технология Солютаб) обладает лучшей биодоступностью по сравнению с амоксициллином в виде таблеток и капсул (93% и 70–80%, соответственно), что способствует повышению эффективности и снижению риска нежелательных явлений со стороны кишечника [49].
Больным с фоновыми заболеваниями или принимавшим АБП в предшествующие 3 месяца назначается амоксициллин/клавуланат или ЦС-2 [13], [15], [16], [23]. В регионах с высоким уровнем резистентности S. pneu moniae к пенициллину и у детей с риском того, что заболевание вызвано резистентным штаммом (прежде всего — нахождение в детских учреждениях с круглосуточным пребыванием) рекомендуется использование дозы амоксициллина в 2 раза выше — 80–90 мг/кг в сутки. В случае, если у ребенка одновременно имеется высокий риск того, что инфекция может быть вызвана β-лактамазопродуцирующим штаммом H. infl uenzae, лучшим выбором является использование амоксициллина/клавуланата с высоким содержанием амоксициллина (препараты с соотношением амоксициллина и клавуланата 14:1 с 3 месяцев до 12 лет и 16:1 после 12 лет), что дает возможность использовать дозу амоксициллина 90 мг/кг/сут, не повышая дозу клавуланата.
При выборе режима АБТ нужно учитывать, что предиктором эффективности β-лактамных антибиотиков является показатель Т>МПК (Т — время между приемами препарата, когда его концентрация в крови выше МПК для возбудителя). Если Т>МПК превышает 40%, наблюдается надежный эффект, когда показатель превышает 50% — максимальный. Показано, что суточная доза амоксициллина и амоксициллина/клавуланата, разделенная на 3 приема (каждые 8 ч), обеспечивает достоверно больший показатель Т > МПК для пневмококка, чем аналогичная суточная доза, разделенная на 2 приема (каждые 12 ч). В связи с этим, у пациентов с ВП, особенно тяжелой, целесообразно разделение суточной дозы амоксициллина и ИЗАП на 3 приема [50]. При наличии признаков ВП микоплазменной или хламидийной этиологии, а также у пациентов с установленной аллергией на β-лактамы целесообразно назначение макролидов. Во втором случае необходимо учитывать, что резистентность S.pneumoniae к 16–членным макролидам (джозамицин, мидекамицин, спирамицин) наблюдается реже. В случаях отсутствия ответа на стартовую эмпирическую терапию (в особенности у детей старше 5 лет) рекомендуется добавить к β-лактамному антибиотику макролидный [15], [16].
Возбудитель и его значение при ВП у детей |
Терапия выбора |
Ситуации, требующие назначения альтернативной терапии |
Альтернативная терапия |
1 |
2 |
3 |
4 |
S.pneumoniae — основной возбудитель ВП у детей от 3 мес до 5 лет, частый возбудит ель ВП у детей старше 5 лет, нечастый возбудитель ВП у детей до 3 мес |
Амоксициллин в стандартной дозе — 45–50 мг/кг в сутки перорально Ампициллин парентерально |
Риск резистентности к S.pneumoniae к пенициллинам или выделение PRSP |
Амоксициллин в высокой дозе — 80–90 мг/кг в сутки перорально |
Микст-инфекция или подозрение на нее у пациента получавшего β-лактамные антибиотики в последние 3 мес |
ИЗАП в стандартной дозе — 45–50 мг/кг в сутки (по амоксициллину), ЦС-2 перорально |
||
Риск резистентности к S.pneumoniae к пенициллинам или выделение PRSP + микст-инфекция или подозрение на нее у пациента, получавшего β-лактамные антибиотики в последние 3 мес |
ИЗАП в высокой дозе — 80–90 мг/кг в сутки (по амоксициллину) перорально |
||
Аллергия на β-лактамы |
|||
Тяжелое течение, развитие осложнений |
ЦС-2, ЦС-3 (цефотаксим, цефтриаксон), респираторные фторхинолоны парентерально [3] |
||
H.infl uenzae — редкий возбудит ель ВП у детей, основное значение у детей от 3 мес до 5 лет |
Амоксициллин в стандартной дозе — 45–50 мг/кг в сутки перорально Ампициллин парентерально |
Риск продукции β-лактамаз H.infl uenzae, выделение штаммов продуцирующих β-лактамазы или эмпирическая АБТ у пациента, получавшего β-лактамные антибиотики в последние 3 мес |
ИЗАП в стандартной дозе — 45–50 мг/кг в сутки (по амоксициллину) перорально, ЦС-2 или ЦС-3 парентерально или перорально [4] |
Аллергия на β-лактамные антибиотики |
Макролиды (азитромицин, кларитромицин) перорально, фторхинолоны парентерально [2],[3] |
||
Тяжелое течение, развитие осложнений |
ИЗАП, ЦС-3, ЦС-4, или карбапенемы парентерально |
||
S.aureus — редкий возбудитель ВП у детей, основное значение до 3 мес S.agalactiae — частый возбудитель ВП у детей до 3 мес S.pyogenes — редкий возбудитель ВП у детей |
Оксациллин парентерально Цефазолин парентерально Ампициллин парентерально Бензилпенициллин парентерально Амоксициллин перорально |
Аллергия на β-лактамные антибиотики |
Линкозамиды парентерально или перорально |
Риск резистентности к S.aureus к метициллину или выявление MRSA |
Ванкомицин парентерально, линезолид парентеральн о или перорально [5] |
||
Микст-инфекция или подозрение на нее у пациента, получавшего β-лакт амн ые антибиотики в последние 3 мес |
ИЗАП, ЦС-2 перорально |
||
Аллергия на β-лактамные антибиотики |
Макролиды перорально [1], линкозамиды парентерально или перорально |
||
Тяжелое течение, развитие осложнений |
ИЗАП, ЦС-2, ЦС-3 (цефотаксим, цефтриаксон), ванкомицин парентерально |
||
Бактерии семейства Enterobacteriaceae (E.coli, K.pneumoniae и др.) — редкие возбудители ВП у детей, основное значение до 3 мес |
ИЗАП ± аминогликозид парентерально |
ЦС-2, ЦС-3 или ЦС-4 ± аминогликозид парентерально |
|
Выявление штамма, продуцирующего β-лактамазы расширенного спектра |
Карбапенемы ± аминогликозид парентерально |
||
M.pneumoniae и C.pneumoniae — частые возбудители ВП у детей старше 5 лет, редкие возбудители ВП у детей с 3 мес до 5 лет C.trachomatis — нечастый возбудитель ВП у детей до 3 мес L.pneumophila — редкий возбудит ель ВП у детей |
Макролиды [1] перорально |
Тяжелое течение |
Макролиды или респираторные фторхинолоны парентерально [3] |
Доксициклин перорально [6] |
У госпитализированных детей с сопутствующими заболеваниями или получавших АБТ в последние 3 месяца назначаются ИЗАП или цефуроксим парентерально в сочетании с макролидом. Пациентам, переведенным в ОРИТ назначают ЦС 3–4 поколения или карбапенемы в сочетании с макролидом. АБТ в стационаре необходимо начинать в течение первых 2 часов после госпитализации и в течение одного часа от момента поступления в ОРИТ [3].
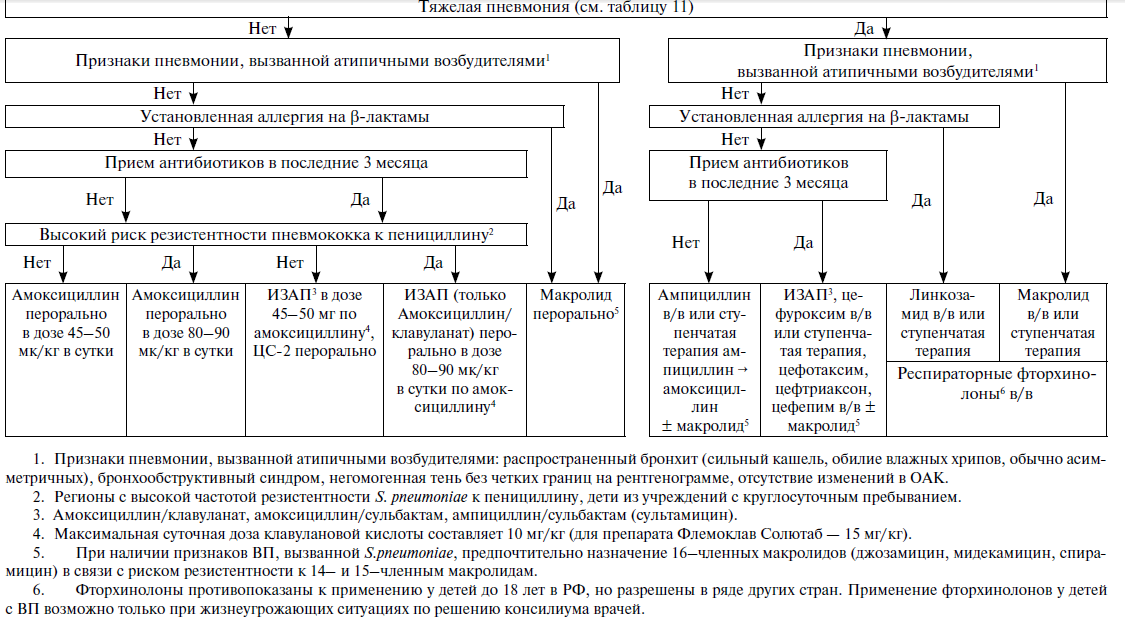
Алгоритм выбора стартовой эмпирической антибактериальной терапии при ВП у детей представлен на схеме см.рисунок 2. Дозы и режим применения антибактериальных препаратов при ВП у детей представлены в приложении F и приложении G.
В случае парентерального назначения АБП рекомендуется ступенчатая терапия — двухэтапное применение антибиотиков: переход с парентерального введения на пероральный прием после улучшения состояния пациента (обычно через 2–3 дня после начала лечения). Это приводит к уменьшению стоимости лечения и сокращению сроков пребывания стационаре при сохранении высокой эффективности [3], [16].
Оптимальным вариантом ступенчатой терапии является последовательное использование двух лекарственных форм (для парентерального введения и приема внутрь) одного и того же антибиотика. Возможно применение АБП, близких по антимикробным свойствам, например: ампициллин — амоксициллин; цефотаксим или цефтриаксон — амоксициллин/клавуланат [3].
Оценка эффективности АБТ проводится через 48 ч от ее начала. В случае недостаточности или отсутствия эффекта необходима коррекция — замена АБП или добавление второго препарата [1].
Длительность АБТ определяют тяжесть и течение заболевания, а также наличие фоновых заболеваний. При ВП, вызванной типичными бактериями длительность терапии обычно составляет 7–10 дней, атипичными бактериями — 10–14 дней [3], [13], [15], [16]. АБТ может быть завершена через 3–4 дня после стойкой нормализации температуры тела [3].
В последние годы наблюдается тенденция к сокращению сроков использования АБП, даже при тяжелом варианте течения ВП [16], [23].
В Кохрановском систематическом обзоре (2008 г.) было показано, что эффективность 3-дневного курса АБТ у детей в возрасте от 2 месяцев до 5 лет с нетяжелой пневмонией не уступает по эффективности более длительному курсу лечения [51]. Однако, результаты данного обзора были подвержены обоснованной критике в связи с тем, что большинство детей во включенных в обзор исследованиях вероятнее всего имели вирусную инфекцию, и, соответственно, назначение АБТ у них не требовалось. Результаты доказательных исследований, в которых диагноз ВП подтверждался рентгенологически, показывают недостаточную эффективность 3-дневного курса АБТ [50].
Эксперты РРО и ATS/IDSA считают, что продолжительность АБТ при ВП должна составлять не менее 5 дней.
Исследования последних лет показали возможность сокращения длительности АБТ при ВП у детей в 1,5–2 раза (с 9–11 до 5–6 сут) под контролем уровня ПКТ крови. Это позволяет без снижения эффективности сократить потребление АБП, сократить сроки госпитализации, уменьшить число нежелательных лекарственных явлений, а также способствует сдерживанию роста резистентности бактерий. Определения уровня ПКТ крови полезно у всех госпитализированных детей с ВП (желательно использование приборов с функциональной чувствительностью 0,1 нг/мл и ниже). Ключевые принципы проведения АБТ под контролем уровня ПКТ представлены в таблице. [50].
| Уровень ПКТ крови | < 0,25 нг/мл | ≥ 0,25 нг/мл |
|---|---|---|
Рекомендации по АБТ |
Не назначать/завершить |
Назначить/продолжить |
Примечания При |
Если АБТ не назначена или отменена — нужно определить уровень ПКТ через 6–24 часов. Необходимо рассмотреть вопрос о назначении/продолжении АБТ в следующих случаях:
|
Важно учитывать динамику уровня ПКТ. Рекомендуется повторять анализ каждые 48 часов. Если пиковое значение было очень высоким — рекомендуется завершить АБТ при понижении уровня ПКТ на 80–90% от пикового значения. Если уровень ПКТ не снижается — целесообразно пересмотреть терапию |
Типичные ошибки при проведении АБТ у детей с ВП представлены в таблице.
| Ошибка | Комментарий |
|---|---|
Назначение ампициллина внутрь |
Низкая биодоступность при приеме внутрь |
Назначение ко-тримоксазола |
Высокая резистентность S. pneumoniae и H. infl uenzae, опасные нежелательные реакции |
Назначение гентамицина |
Аминогликозиды неактивны в отношении пневмококка, внутриклеточных возбудителей |
Назначение фторхинолонов |
Противопоказаны до 18 лет, за исключением жизнеугрожающих ситуаций |
Необоснованный отказ от назначения амоксициллина при пневмококковой пневмонии |
ИЗАП и ЦС не имеют преимуществ перед амоксициллином в отношении S. pneumoniae Макролиды и линкозамиды рекомендуются только при аллерг ии на β-лактамы |
Сочетание антибиотиков с противогрибковыми препаратами |
Отсутствие доказательств профилактической эффективности, необоснованные затраты |
Сочетание антибиотиков с антигистаминными препаратами |
Отсутствие доказательств профилактической эффективности, необоснованные затраты |
Парентеральное назначение АБП при среднетяжелой ВП |
Пероральные АБП не уступают парентеральным по эффективности при неосложненной ВП Применение пероральных АБП более безопасно |
Частая смена АБП |
Показания для замены антибиотиков:
|
Продолжение АБТ до полного исчезновения рентгенологических и/или лабораторных изменений |
Основным критерием отмены антибиотиков является регресс клинических симптомов, сохранение отдельных лабораторных и рентгенологических изменений не является основанием для продолжения АБТ |
7.3. Противовирусная терапия
Применение противовирусных препаратов показано при ВП вирусной этиологии (прежде всего гриппозной), а также при ВП, развившейся на фоне текущей ОРВИ. К средствам, оказывающим прямое противовирусное действие, относятся ингибиторы нейраминидазы (озельтамивир, занамивир), умифеновир, инозин пранобекс и препараты адамантанового ряда (амантадин, римантадин). Основные характеристики препаратов представлены в таблице.
| Препарат | Основной механизм действия | Спектр активности | Примечания |
|---|---|---|---|
Озельтамивир |
Ингибирование нейраминидазы |
Вирус гриппа А и В |
|
Занамивир |
|||
Умифеновир |
Препятствие слиянию оболочки вируса и клеточной мембраны |
Вирус гриппа А и В |
Оказывает также иммуномодулирующ ее действие |
Инозин пранобекс |
Подавление репликации ДНК и РНК вирусов |
Вирус гриппа, вирус кори и другие |
Оказывает также иммуномодулирующее действие |
Римантадин |
Препятствие слиянию оболочки вируса и клеточной мембраны |
Вирус гриппа А |
Малоэффективены в связи с высоким уровнем резистентности |
Амантадин* |
* В РФ препарат не зарегистрирован для лечения гриппа.
Осельтамивир и занамивир используются для лечения и профилактики гриппа. Эффективность ингибиторов нейраминидазы у детей показана в кохрановских мета-анализах, включавших большое число доказательных клинических исследований [52], [53].
Умифеновир обладает прямым противовирусным и иммуномодулирующим действием. В ряде клинических исследований показана эффективность препарата при гриппе [54].
Инозин пронабекс обладает прямым противовирусным и иммуномодулирующим действием. В клинических исследованиях показана эффективность препарата при различных вирусных инфекциях, в том числе при гриппе [55], [56].
Римантадин и амантадин в настоящее время не рекомендуются к использованию для лечения и профилактики гриппа в связи с узким спектром действия (вирус гриппа А), высоким уровнем резистентности и частыми нежелательными явлениями.
В качестве противовирусного средства также используется имидазолилэтанамид пентандиовой кислоты (Ингавирин), который увеличивает количество и активность интерфероновых рецепторов зараженной клетки, нейтрализует иммуносупрессивную активность вирусов, останавливает созревание и репликацию вирусов. Препарат применяется у взрослых и детей старше 13 лет для лечения и профилактики гриппа и ОРВИ. В настоящее время проведены клинические испытания, показавшие эффективность Ингавирина у детей с 6-летнего возраста.
Выбор противовирусной терапии у детей имеет возрастные ограничения. Целесообразно для повышения эффективности использовать сочетанное введение противовирусных средств прямого действия и селективного индуктора интерферонов эргоферона, обладающего противовирусным, противовоспалительным и антигистаминным действием см.рисунок.
Дозы и режим применения противовирусных препаратов представлены в приложении H.
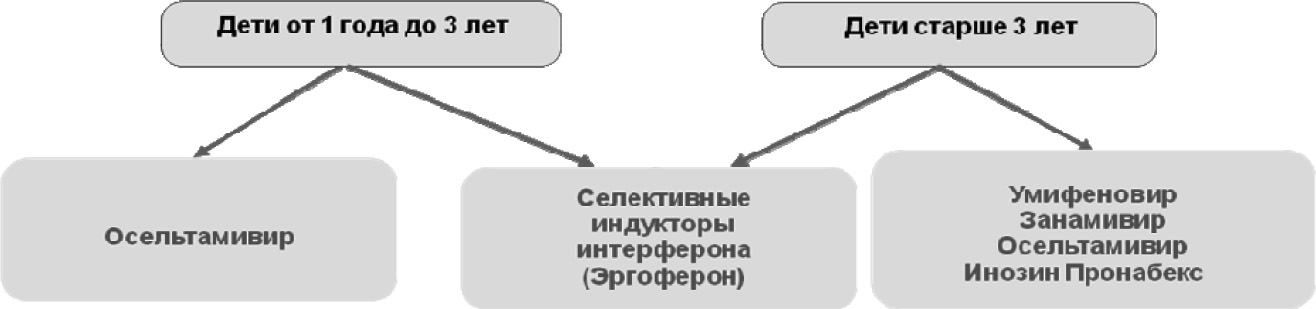
7.4. Другие направления терапии
Оксигенотерапия показана пациентам, насыщение кислородом у которых составляет меньше 92%. Кислород подается интраназально или лицевой маской [1].
Кортикостероиды у детей с ВП целесообразно использовать только в отдельных случаях при тяжелом течении заболевания и/или развитии осложнений. По данным ряда исследований у взрослых пациентов назначение глюкокортикоидов перорально в виде короткого курса улучшают результаты лечение пневмонии, что выражается в более быстром наступлении клинического эффекта, уменьшении сроков госпитализации и снижении потребности в применении парентаральных антибиотиков [57]. В исследовании на небольшой группе детей с тяжелой ВП было показано, что внутривенное введение метилпреднизолона (в дозе 0,5–2 мг/кг в сутки в течение 5 дней) достоверно уменьшает длительность лихорадки, длительность госпитализации и частоту развития осложнений [58].
Инфузионная терапия показана пациентам с интоксикацией и тяжелой пневмонией в объеме не более 40 мл/кг/сут под контролем диуреза, электролитов сыворотки крови, гематокрита. Выраженных потерь жидкости при пневмонии не наблюдается (кроме потерь на перспирацию), поэтому оральная гидратация назначается по физиологической потребности у всех больных с неосложненной пневмонией и у 80–90% больных с осложненной пневмонией.
Антипиретики (парацетамол, ибупрофен) при пневмонии используют по потребности. Плановое назначение антипиретиков противопоказано, так как оно затрудняют оценку эффективности терапии.
Муколитическая терапия может оказывать положительный эффект у детей с пневмонией [59]. Так, например, муколитик амброксол усиливает проникновение в бронхиальный секрет и легочную ткань антибиотиков — амоксициллина, цефуроксима и эритромицина, и стимулирует синтез сурфактанта, тем самым повышая эффективность АБТ при бактериальных процессах в легких. Назначение N-ацетилцистеина, обладающего прямым муколитическим действием, показано у детей с хронической патологией легких, а также при наличии большого количества мокроты гнойного характера [60].
Бронхоспазмолитическая терапия показана при наличии сопутствующего бронхообструктивного синдрома или при возникновении пневмонии у больного бронхиальной астмой. Бронхообструктивный синдром может возникнуть при ВП микоплазменной, хламидийной или вирусной этиологии. Показано ингаляционное применение β2-агонистов короткого действия в виде монотерапии или в комбинации с м-холинолитиком (предпочтительно через небулайзер). Длительность терапии определяется клинической симптоматикой. Антигистаминные препараты показаны только у детей с обострением атопических заболеваний на фоне ВП.
Назначение пробиотиков рекомендуется у пациентов с фоновыми заболеваниями желудочно-кишечного тракта. Рутинное назначение пробиотиков при АБТ необоснованно.
Доказательств влияния физиотерапии на течение ВП в настоящее время недостаточно [23].
7.5. Терапия осложнений пневмонии
Лечение осложненных форм ВП проводится в учреждениях II–III уровня, при необходимости с участием торакального хирурга и анестезиолога-реаниматолога.
Синпневмонический плеврит: адекватная терапия основного заболевания.
Метапневмонический плеврит: назначение нестероидных противовоспалительных препаратов или глюкокортикоидов — преднизолон перорально 1 мг/кг в сутки на 2–4 дня [23].
При пневмотораксе выбор тактики определяется его объемом: при малых объемах лечение консервативное — оксигенотерапия и наблюдение, при больших — дренаж, на фоне которого стойкое расправление легкого наблюдается на 3–9-й день [23], [30].
Абсцесса легкого: бронхоскопическая санации или трансторакальное дренирование катетером в течение 4–6 дней [30].
Пиопневмоторакса: дренирование плевральной полости с активной аспирацией. Сроки дренирования составляют от 7 до 14 дней. В тех случаях, когда не удается расправить легкое, используют метод временной окклюзии бронха [30].
7.6. Особенности терапии пневмонии у детей с детским церебральным параличом
Принципы лечения пневмонии у пациентов с ДЦП [31]:
-
Раннее назначение этиотропной терапии при подозрении на пневмонию.
-
Санация дыхательных путей — удаление слизи, мокроты для лучшей аэрации.
-
Обязательное использование вспомогательной терапии — небулайзерной ингаляционной терапии, дренирующего массажа для активной эвакуации мокроты.
-
При неэффективном откашливании мокроты рекомендуются специальные дыхательные методики, а иногда и аппаратная аспирация
-
При выраженном снижении легочной функции (ФЖЕЛ <50%), симптомах диафрагмальной дисфункции (ортопноэ) и/или гиповентиляции (гиперкапния) показана вентиляционная поддержка (важен адекватный выбор оборудования и режима вентиляции, рекомендуются портативные аппараты для вентиляционной поддержки). Показаниями к ИВЛ являются гиперкапния, десатурация во время ночного сна (в том числе артериальная), ортопноэ, ФЖЕЛ < 50% от должного.
-
Назначение препаратов комбинированного действия — нейроиммунопротекторов (пантогам, элькар), которые позволяют одновременно улучшить состояние иммунной и нервной систем.
-
Назначение иммунокоррегирующей терапии.
Важное значения для снижения риска пневмонии имеет профилактика аспирации:
-
Продолжить энтеральное питание до тех пор, пока с помощью методов оценки глотания не выявлены признаки аспирации
-
Уменьшение порций и повышение вязкости пищи
-
Использование специальных приемов для облегчения глотания и прием пищи в вертикальном положении
-
В случае невозможности выполнения или низкой эффективности указанных выше мероприятий и у пациентов с тяжелой дыхательной недостаточностью (ФЖЕЛ < 50% от должного) для снижения риска респираторных осложнений показана установка гастростомического зонда под эндоскопическим или рентгеновским контролем.
-
Низкодозированные опиоиды могут быть использованы для управления тревожным состоянием при одышке на фоне основной терапии (при медленном титровании опиоидов угнетение дыхания маловероятно).
-
При заболеваниях дыхательных путей c вязкой мокротой рекомендуется ингаляции изотонического раствора (0,9% NaCl) для удаления слизистых пробок из трахеи крупных бронхов (которые могут привести к непроходимости дыхательнных путей) и улучшения мукоциллиарного клиренса [33].
7.7. Особенности терапии пневмонии у детей с муковисцидозом
-
При проведении АБТ следует ориентироваться на чувствительность выделенного микроорганизма или ассоциации к антибиотикам. АБП против известного возбудителя (P.aeruginosa, MRSA, Burkholderia cepacia, Stenotrophomonas maltophilia и др.) назначают с учетом известной чувствительности или положительного эффекта при терапии предшествующего обострения легочной инфекции.
-
Назначают максимальные возрастные дозы препаратов или специальные дозы, рекомендуемые для лечения муковисцидоза. Применение высоких доз связано с особенностями фармакокинетики антибиотиков при муковисцидозе.
-
Обнаружение in vitro резистентности к АБП не является основанием для изменения лечения у пациентов, в случае если получен клинический ответ на проводимую терапию.
-
Внутривенное введение антибиотиков начинается в стационаре, после появления положительной клинической динамики лечение может быть продолжено в амбулаторных условиях.
-
АБТ необходимо сочетать с активной кинезитерапией.
-
Длительность АБТ составляет в среднем 14–21 день.
-
При отсутствии в мокроте больного до развития пневмонии патологически значимой микрофлоры терапию проводят по общепринятым рекомендациям, но антибиотик назначается в максимальной дозе курсом не менее 14 дней.
-
При пневмонии у пациентов на фоне хронической инфекции, вызванной S.aureus, назначают противостафилококковые антибиотики для приема внутрь (оксациллин, ЦС-1, ЦС-2, макролиды, ко-тримоксазол, рифампицин). При тяжелом обострении бронхолегочного процесса стафилококковой этиологии применяются ЦС-1 или ЦС-2 поколения парентерально.
-
У детей раннего возраста имеет значение H.infl uenzae. При пневмонии, вызванной данным возбудителем рекомендуются: амоксициллин/ клавулановая кислота, цефаклор, цефиксим, кларитромицин, азитромицин, ко-тримоксазол, согласно антибиотикограмме. При сохранении признаков обострения бронхолегочного процесса и повторном высеве H.infl uenzae, рекомендуется проведение курса АБТ внутривенно (цефтриаксон и другие ЦС).
-
АБТ пневмонии при высеве из бронхиального секрета P.aeruginosa впервые или в анамнезе назначают аминогликозиды, антисинегнойные пенициллины и ЦС, фторхинолоны, карбапенемы. Применение внутрь препаратов из группы фторхинолонов (ципрофлоксацин, левофлоксацина) после курса внутривенной АБТ позволяет улучшить и пролонгировать клинический эффект. Эффективно сочетание таблетированных антибиотиков с ингаляционными антибиотиками.
-
используют два АБП;
-
препараты первой линии — ЦС-3 (цефтазидим) или ЦС-4 (цефепим) + аминогликозид (тобрамицин или амикацин);
-
препараты второй линии: карбапенем (меропенем) + аминогликозиды (тобрамицин или амикацин);
-
альтернативные комбинации: пиперациллин/тазобактам + тобрамицин или имипенем + амикацин;
-
внутривенная комбинация двух β-лактамных антибиотиков (пиперациллин, цефтазидим, цефепим, имипенем, меропенем и др.) не рекомендуется;
-
длительность лечения должна составлять 14–21 день и более;
-
необходимо проводить контроль за нефротоксичным и ототоксичным действием аминогликозидов.
Важное значение в лечении пневмонии у пациентов с муковисцидозом играет ингаляционная АБТ. При выделении P.aeruginosa применяются колистиметат (колистин, полимиксин Е) и тобрамицин, при выделении S.aureus или Burkholderia cepacia — тиамфеникол. При аэрозольном пути доставки антибиотиков в бронхиальном секрете создаются высокие концентрации препарата, при низком их уровне в сыворотке крови и низком риске развития системных побочных эффектов. При пневмонии, так же как при обострениях хронической инфекции дыхательного тракта, ингаляционная АБТ назначается в комбинации с внутривенной и пероральной АБТ. Одновременное назначение АБП для ингаляционного и внутривенного путей введения одной группы не рекомендуется [39], [40].
8. ПРОФИЛАКТИКА ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
8.1. Неспецифическая профилактика
Неспецифическая профилактика ВП у детей формируется из комплекса мероприятий, предупреждающих возникновение ОРВИ: соблюдение принципов здорового образа жизни (естественное вскармливание как минимум до 6-месячного возраста, своевременное введение прикорма, достаточное пребывание на свежем воздухе, ограничение контактов в период повышенной заболеваемости, использование барьерных средств защиты и пр.). В группе детей с повторяющимися инфекциями целесообразно в плановом порядке использовать медикаментозные средства (релиз-активные препараты на основе антител к интерферону гамма или другие препараты с иммуномодулирующим эффектом). Селективные индукторы интерферона влияют на вирус-индуцированную продукцию интерферонов альфа и гамма, а также восстанавливают связывающую способность рецепторов. В периоде реконвалисценции эти препараты восстанавливают способность клеток вырабатывать интерфероны при встрече с вирусными возбудителями и, таким образом, защищают организм от повторных инфекций [61]. Эргоферон кроме того характеризуется выраженной противовирусной активностью и дополнительно снижает выработку гистамина и выраженность гистамин-зависимых реакций. Опыт применения показал, что он эффективен и безопасен при назначении как эпизодически болеющим детям, так и пациентам с рекуррентным течением инфекций и у детей с аллергическими заболеваниями [62].
Также для профилактики ОРВИ у детей могут использоваться препараты интерферонов и различные препараты с иммуномодулирующим действием: Кагоцел, тилорон, дезоксирибонуклеат натрия, эхинацея пурпурная, пидотимод, Афлубин и др. Однако, большинство из этих средств на сегодняшний день не имеют достаточной доказательной базы.
Барьерные средства (антисептики местного действия) используются для профилактики эпизодически или ежедневно (в период повышенной заболеваемости). Назаваль плюс, в состав которого входит микроцеллюлоза и экстракт дикого чеснока, показан детям с повторяющимися инфекциями респираторной системы, посещающим организованные детские коллективы, при близком контакте с больным ОРВИ, пациентам с ослабленным иммунитетом [63].
8.2. Специфическая профилактика
Специфическая профилактика ВП включает иммунизацию против пневмококковой и гемофильной инфекции, гриппа, а также против коклюша, кори и РС-инфекции.
Для профилактики пневмококковой инфекции используют вакцины (коньюгированные с белком и полисахаридные), создающие защиту от наиболее распространенных и опасных серотипов S.pneumoniae. В 2014 г. вакцинация против пневмококка включена в российский национальный календарь прививок и календарь прививок по эпидемическим показаниям.
Вакцины коньюгированные с белком (ПКВ) содержат полисахариды 10 (1, 4, 5, 6B, 7f, 9V, 14, 18C, 19F, 23F) или 13 (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 23F) серотипов пневмококка. За счет конъюгации полисахаридов с белком-носителем данные вакцины обеспечивают Т-зависимую защиту, в том числе у детей раннего возраста (начиная с 2 месяцев жизни) [1], [64]. В мире накоплен опыт массовой иммунизации детей раннего возраста ПКВ. В Кохрановском обзоре, включающем мета-анализ 11 сравнительных исследований в разных странах мира (более 113 тыс. детей до 2 лет), было показано, что массовая вакцинация ПКВ достоверно снижает частоту рентгенологически подтвержденных пневмоний [65]. Высокая эффективность ПКВ для предотвращении пневмонии была подтверждена и в более поздних систематических обзорах [66], [67]. Исследование, проведенное в США показало, что за 10 лет после внедрения универсальной вакцинации ПКВ частота госпитализации детей в возрасте до 2 лет по поводу ВП снизилась на 43% [68]. В целом, в результате внедрения ПКВ отмечено значительное снижение общего бремени пневмококковой инфекции, в том числе ВП.
Вакцина полисахаридная (ППСВ) представляет собой смесь полисахаридов пневмококка и обеспечивает В-зависимую защиту у взрослых и детей старше двух лет против 23 серотипов (1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, 33F) возбудителя. Длительность иммунитета после прививки данной вакциной составляет 5–8 лет.
Ключевые рекомендации по вакцинопрофилактике пневмококковой инфекции представлены в таблице. [1], [64].
Группами риска, подлежащими вакцинации против пневмококка, являются:
-
лица с хроническими бронхолегочными заболеваниями, в том числе бронхиальной астмой, наследственными и врожденными заболеваниями легких, ХОБЛ и пр.;
-
пациенты с тяжелым течением заболеваний системы кровообращения (сердечной недостаточностью, кардиомиопатией, ВПС);
-
больные сахарным диабетом, проградиентным течением заболеваний печени и почек;
-
лица с функциональной или анатомической аспленией, ликвореей, кохлеарной имплантацией, нарушением иммунитета;
-
больные онкогематологическими заболеваниями, ВИЧ-инфекцией, нейтропенией;
-
часто болеющие респираторными инфекциями верхних и нижних дыхательных путей, в том числе инфицированные туберкулезом.
Детям из групп риска рекомендуется в возрасте до 2 лет провести вакцинацию ПКВ, а после старше 2 лет дополнительно полисахаридной вакциной (не ранее чем через 8 недель после ПКВ) [64].
| Тип вакцин | Пневмококковая конъюгированная | Пневмококковая полисахаридная |
|---|---|---|
Торговые наименов ания |
Превенар 13, Синфлорикс |
Пневмо23 |
Состав вакцины |
Полисахариды капсулы 10 или 13 серотипов пневмококка, конъюгированные с белком. |
Полисахариды капсулы 23 серотипов пневмококка |
Рекомендуемые группы |
Все дети в возрасте до 5 лет (включительно) |
Дети групп высокого риска с 2-летнего возраста, подростки- курильщики |
Путь введения |
Внутримышечно |
|
Рекомендуемые сроки вакцинации |
2 месяца и 4,5 месяца |
Однократно с 2 лет по показаниям |
Для иммунопрофилактики гемофильной инфекции используются полсахаридные вакцины. Вакцинация рекомендована для детей до 5 лет, начиная с 3 месяцев жизни. Схема иммунизации включает трехкратное введение вакцины, совмещенное с введением вакцин против коклюша, дифтерии, столбняка и полиомилита (в 3–4,5–6 месяцев). Ревакцинация проводится в 18 месяцев [64].
В случаях, когда вакцинация против пневмококковой и гемофильной инфекции начинается в возрасте старше 6 месяцев изменяется режим проведения прививок таблица
| Возраст ребенка | Вакцинация и ревакцинация против пневмококковой инфекции | Вакцинация и ревакцинация против гемофильной инфекции |
|---|---|---|
6–11 мес. |
Двукратная вакцинация с интервалом не менее 1 месяца и ревакцинация через 1 год |
|
1–2 года |
Двукратное введение вакцины с интерв алом не менее 2 месяцев |
Однократное введение вакцины |
2–5 лет |
Однократное введение вакцины |
|
Вакцинация против гриппа проводится до начала эпидемического сезона детям с возраста 6 месяцев субъединичными (Гриппол, Агриппал, Инфлювак) или расщепленными (Ваксигрипп, Бегривак, Флюарикс, Ультрикс) инактивированными вакцинами. Вакцинация против гриппа показана следующим категориям детей:
-
организованные дети дошкольного возраста (посещающие ДОУ);
-
учащиеся с 1-го по 11-й класс;
-
учащиеся средних профессиональных учреждений;
-
студенты высших учебных заведений.
Прививочная доза составляет 0,25 мл для детей до 3 лет и 0,5 мл для детей старше 3 лет и взрослых. Ранее не болевшим гриппом и впервые вакцинируемым против гриппа показано введение двух доз вакцины с интервалом 4 недели.
Показания к химиопроф илактике оппортунистических инфекций нижних дыхательных путей у ВИЧ-инфициров анных пациентов [35]:
-
при уровне лимфоцитов CD4+ < 200/мкл для профилактики пневмоцистной пневмонии назначается ко-тримоксазол в дозе 3мг/кг 1 раз в сутки;
-
при уровне лимфоцитов CD4+ < 50/мкл для инфекц ии вызванной микобактериями изониазид 5мг/кг 1 раз сутки.
В ноябре 2009 г. ВОЗ и ЮНИСЕФ представили Глобальный план действий по профилактике пневмонии (ГПДП) [66], основной целью которого является ускорение темпов борьбы с пневмонией в условиях принятия комплексных мер, направленных на выживание детей:
-
защита каждого ребенка путем обеспечения окружающей среды, где дети подвергаются низкому риску развития пневмонии (исключительное грудное вскармливание в течение 6 месяцев, надлежащее питание, профилактика низкой массы тела при рождении, снижение уровня загрязнения воздуха внутри помещений, мытье рук);
-
профилактика заболевания детей пневмонией в соответствие с национальным календарем прививок;
-
лечение детей, заболевших пневмонией, с обеспечением правильного ухода и рациональной антибиотикотерапии.
По мнению экспертов ВОЗ и ЮНИСЕФ, реализация этого плана будет способствовать снижению смертности детей от пневмонии в 2015–2020 гг. на 65% и уменьшению числа случаев заболевания тяжелой пневмонией среди детей на 25% по сравнению с показателями 2000 г.
СПИСОК ЛИТЕРАТУРЫ
-
[1] Внебольничная пневмония у детей: распространенность, диагностика, лечение, профилактика. Научно-практическая программа. М.: Оригинал-макет, 2010. 64 с.
-
[2] Рабочая классификация основных клинических форм бронхолегочных заболеваний у детей / Геппе Н. А., Розинова Н. Н., Волков И. К., Мизерницкий Ю. Л. Российское респираторное общество, 2009. 18 с.
-
[3] Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике: пособие для врачей / Чучалин А. Г., Синопальников А. И., Козлов Р. С., Тюрин И. Е., Рачина С. А. Москва, 2010. 106 с.
-
[4] Сведения об инфекционных и паразитарных заболеваниях (форма 1) // URL: http://www.rospotrebnadzor.ru.
-
[5] Crawford S. E., Daum R. S. Bacterial pneumonia, lung abscess and empyema / Pediatric respiratory medicine / ed. Taussig L. M., Landau L. I. Mosby, Inc., 2008: 501–553.
-
[6] Лютина Е. И., Манеров Ф. К. Заболеваемость и смертность от внебольничной пневмонии у детей и подростков, проживающих в Кузбассе// Педиатрия. 2015. № 2. С. 203–206.
-
[7] ВОЗ. Информационный бюллетень № 331 (ноябрь 2014 г.) // URL: http://www.who.int/mediacentre/factsheets/fs331/ru/.
-
[8] Nair H., Simões E.A., Rudan I., et al. Severe Acute Lower Respiratory Infections Working Group. Global and regional burden of hospital admissions for severe acute lower respiratory infections in young children in 2010: a systematic analysis // Lancet. 2013. Vol. 381. Р. 138013–90.
-
[9] Мизерницкий Ю. Л., Сорокина Е. В., Ермакова И. Н. и др. Организация медицинской помощи детям с пневмонией в Российской Федерации // Рос. вестн. перинатол. и педиатрии. 2005. Т. 3. С. 4–8.
-
[10] Torres A., Menendez R., Wunderink R. Chapter 32 — Pyogenic Bacterial Pneumonia, Lung Abscess, and Empyema / Murray & Nadel’s Textbook of Respiratory Medicine, 5th ed. Copyright © 2010 Saunders, An Imprint of Elsevier.
-
[11] Niederman M. S., Mandell L. A., Anzueto A. et al. Guidelines for the management of adults with community-acquired pneumonia. Diagnosis, assessment of severity, antimicrobial therapy, and prevention // Am J Respir Crit Care Med. 2001; 163: 1730–1754.
-
[12] Wunderink R. G., Mutlu G. M. Pneumonia. In: Encyclopedia of respiratory medicine / Eds: GJ Laurent, SD Shapiro. 2006. V. 3. Р. 402–407. The Bou levard, Langford Lane, Kidlington, Oxford, UK.
-
[13] Esposito S., Patria M.F., Tagliabue C., et al. CAP in children//European respiratory monograph 63: Community-acquired pneumonia/редакторы: J. Chalmers, M.Pletz, S.Aliberti. 2014. Р. 130–139.
-
[14] Rohde G. G. U. The role of viruses in CAP // European respiratory monograph 63: Community-acquired pneumonia/редакторы: J. Chalmers, M. Pletz, S. Alib erti. 2014. P. 74–87.
-
[15] Harris M., Clark J., Coote N., et al. British Thoracic Society guidelines for the management of community acquired pneumonia in children: update 2011// Thorax. 2011. Vol. 66, Suppl. 2–23.
-
[16] Bradley J. S., Byington C. L., Shah S. S., et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America // Clin. Infect. Dis. 2011. Vol. 53. № 7. e25–76.
-
[17] Козлов Р. С., Чагарян А. Н., Козлова Л. В., Муравьёв А. А. Серологическая характеристика и чувствительность к антибиотикам пневмококков, выделенных у детей в возрасте до 5 лет в отдельных регионах Российской Федерации // Клин Микробиол Антимикроб Химиотер. 2011; 13(2):177–187.
-
[18] ERS Handbook: Paediatric Respiratory Medicine/ редакторы: E. Eber, F. Midulla. 2013. 719 p.
-
[19] Rudan I., O’Brien K.L., Nair H., et al. Epidemiology and etiology of childhood pneumonia in 2010: estimates of incidence, severe morbidity, mortality, underlying risk factors and causative pathogens for 192 countries // J. Glob. Health. 2013. Vol. 3. № 1 — 010401.
-
[20] Козлов Р. С. Пневмококки: уроки прошлого — взгляд в будущее. Смоленск: МАКМАХ, 2010. 128 с.
-
[21] Mayanskiy N., Alyabieva N., Ponomarenko O., et al. Serotype distribution and antibiotic-resistance of paediatric Streptococcus pneumoniae in Moscow. ECCMID 2014. P2173.
-
[22] Сивая О. В., Козлов Р. С., Кречикова О. И., и соав. Антибиотикорезистентность Haemophilus infl uenzae в России: результаты многоцентрового проспективного исследования ПеГАС // Клиническая микробиология и антимикробная химиотерапия, 2014. № 1. С. 57–69.
-
[23] Таточенко В. К. Клинические рекомендации. Педиатрия (Пневмония у детей) / под ред. А. А. Баранова. М.: ГЭОТАР-Медиа, 2005. 28 с.
-
[24] Bilkis MD, Gorgal N, Carbone M, Vazquez M, Albanese P, Branda MC, Alterman E, Rodriguez D, Orellana L, Pedrosa OB. Validation and development of a clinical prediction rule in clinically suspected community-acquired pneumonia. Pediatr Emerg Care. 2010 Jun; 26(6):399–405.
-
[25] Холодок Г. Н. Микробиологические и патогенетические аспекты внебольничной пневмонии у детей: автореф. дис. … докт. мед. наук. Москва, 2012. 41 с.
-
[26] Woodhead M., Blasi F., Ewig S. et al. Guidelines for the management of adult lower respiratory tract infections // Eur. Respir. J. 2005. Vol. 26. P. 1138–1180.
-
[27] Протасова И. Н., Перьянова О. В., Ильенкова Н. А. Этиологическая диагностика внебольничной пневмонии у детей (обзор литературы) // Пульмонология. 2014. № 5. С. 78–82.
-
[28] Спичак Т. В., Катосова Л. К., Яцышина С. Б., и соав. Критический взгляд на результаты лабораторной диагностики внебольничной пневмонии микоплазменной этиологии у детей. Педиатрия 2014; 93(3): 46–55.
-
[29] Приложение к приказу МЗ РФ от 20 декабря 2012 г. № 1213н. Стандарт первичной медико-санитарной помощи при пневмонии.
-
[30] Манеров Ф. К. Диагностика и терапия острой пневмонии у детей при разных вариантах течения: дис. … д. м. н. Новокузнецк, 1990.
-
[31] British Thoracic Society guideline for respiratory management of children with neuromuscular weakness / J. Hull, R. Aniapravan, E. Chan, M. Chatwin, J. Forton, J. Gallagher, N. Gibson, J. Gordon, I. Hughes, R. McCulloch // Thorax. 2012. Vol. 67. №. 1.
-
[32] Абдрахманова С. Т., Скучалина Л. Н., Айшауова Р. С. Особенности респираторной патологии у детей с поражением центральной нервной системы // Валеология. 2014. № 4. С. 12–14.
-
[33] Pulmonary complications of neuromuscular disease:clinical guidelines of the s spanish society of pulmonology and thoracic surgery / Farrero E., Egea C. J.et al. Guidelins for the management of respiratory complications in patients with neuromuskular disease. Arch. Bronconeumol. 2013; 49 (7); 306–313/
-
[34] Васильева Т. Е., Литвинова Н. Г., Шагильдян В. И. и соавт. Легочная патология у больных ВИЧ-инфекцией // Тер. архив. 2007. № 11. С. 31–35.
-
[35] Punpanich W., Groome M., Muhe L., et al. Systematic review on the etiology and antibiotic treatment of pneumonia in human immunodefi ciency virusinfected children // Pediatr. Infect. Dis. J. 2011. Vol. 30. № 10. Р. 192–202.
-
[36] Лечение и помощь при ВИЧ/СПИДе. Клинические протоколы для Европейского региона ВОЗ. ВОЗ, 2007. 552 c.
-
[37] Ермак Т. Н. Лечение пневмоцистной пневмонии при ВИЧ-инфекции // Фарматека. 2003. № 13. С. 17–21.
-
[38] Lim W. S., Baudouin S. V., George R. C., et al. BTS guidelines for the management of community acquired pneumonia in adults: update 2009 // Thorax. 2009. Vol. 64. Suppl. 3. P. 1–55.
-
[39] Муковисцидоз / под ред. Н. И. Капранова, Н. Ю. Каширской. М.: ИД «МЕДПРАКТИКА-М», 2014. 672 с. ISBN 978-5-98803-314-1.
-
[40] Проект национального консенсуса «Муковисцидоз: определение, диагностические критерии, терапия». Раздел «Антимикробная терапия» // Педиатрия. Журнал им. Г.Н. Сперанского. 2014. Т. 93. № 4. С. 107–123.
-
[41] Самсыгина Г. А., Дудина Т. А., Талалаев А. Г., Корнюшин М. А. Тяжелые внебольничные пневмонии у детей // Педиатрия. 2005. № 4. С. 87–94.
-
[42] Приложение к приказу МЗ РФ от 29 декабря 2012 г. № 1658н. Стандарт специализированной медицинской помощи при пневмонии средней степени тяжести.
-
[43] Приложение к приказу МЗ РФ от 9 ноября 2012 г. № 741н. Стандарт специализированной медицинской помощи при пневмонии тяжелой степени тяжести с осложнениями.
-
[44] Приложение № 5 к приказу Минздрава СССР от 15 июня 1983 г. № 725. Инструкция по организации восстановительного лечения детей, перенесших острую пневмонию, и их диспансерного наблюдения в амбулаторных условиях.
-
[45] Приказ Министерства здравоохранения РФ от 29 декабря 2012 г. №1705н «О порядке организации медицинской реабилитации».
-
[46] Lodha R., Kabra S. K., Pandey R. M. Antibiotics for community-acquired pneumonia in children // Cochrane Database Syst. Rev. 2013. Vol. 4. № 6. CD004874.
-
[47] Lassi Z. S., Das J. K., Haider S. W., et al. Systematic review on antibiotic therapy for pneumonia in children between 2 and 59 months of age // Arch. Dis. Child. 2014. Vol. 99. № 7. P. 687–693.
-
[48] Das R. R., Singh M. Treatment of severe community-acquired pneumonia with oral amoxicillin in under-fi ve children in developing country: a systematic review // PLoS One. 2013. Vol. 25. № 6. e66232.
-
[49] Таточенко В. К. Антибиотики в лекарственной форме Солютаб // Фарматека. 2010. № 14. С. 46–50.
-
[50] Геппе Н. А., Малахов А. Б., Волков И. К. и соав. К вопросу о дальнейшем развитии научно-практической программы по внебольничной пневмонии у детей // Русский медицинский журнал. 2014. Т. 22. № 3. С. 188–193.
-
[51] Haider B. A., Saeed M. A., Bhutta Z. A. Short-course versus long-course antibiotic therapy for non-severe community-acquired pneumonia in children aged 2 months to 59 months // Cochrane Database Syst. Rev. 2008. Vol. 16. № 2. CD005976.
-
[52] Jeff erson T., Jones M. A., Doshi P., et al. Neuraminidase inhibitors for preventing and treating infl uenza in healthy adults and children // Cochrane Database Syst. Rev., 2014. 548 p.
-
[53] Wang K., Shun-Shin M., Gill P., et al. Neuraminidase inhibitors for preventing and treating infl uenza in children (published trials only) // Cochrane Database Syst. Rev., 2012. 70 p.
-
[54] Blaising J., Polyak S. J., Pécheur E. I. Arbidol as a broad-spectrum antiviral: an update // Antiviral Res. 2014. Vol. 107. P. 84–94.
-
[55] Inosine pranobex -only for use in controlled trials. Drug Ther Bull. 1986. Dec 1;24(24):95–6.
-
[56] Елисеева М. Ю., Царев В. Н., Масихи К. Н. и соав. Эффективность вспомогательной иммунотерапии у пациентов с иммунодефицитом и часто болеющих детей: систематический обзор и мета-анализ применения инозина пранобекса при ОРВИ // РМЖ. 2010; 18 (5:369): 313–320.
-
[57] Annane D. Corticosteroids and pneumonia: time to change practice // Lancet. 2015. Vol. 385. № 9977. P. 1484–1485.
-
[58] Nagy B., Gaspar I., Papp A., et al. Effi cacy of methylprednisolone in children with severe community acquired pneumonia // Pediatr. Pulmonol. 2013. Vol. 48. № 2. P. 168–175.
-
[59] Chang C. C., Cheng A. C., Chang A. B. Over-the-counter (OTC) medications to reduce cough as an adjunct to antibiotics for acute pneumonia in children and adults // Cochrane Database Syst. Rev. 2014. Vol. 10. № 3. CD006088.
-
[60] Малахов А. Б., Дронов И. А. Фармакотерапия кашля у детей с респираторными инфекциями. Consilium Medicum // Педиатрия. 2014. № 1. С. 45–49.
-
[61] Tarasov S. A., Zarubaev V. V., Gorbunov E. A., et al. Activity of ultra-low doses of antibodies to gamma-interferon against lethal infl uenza A(H1N1)2009 virus infection in mice // Antiviral. Res. 2012. Vol. 93. № 2. P. 219–224.
-
[62] Геппе Н. А., Кондюрина Е. Г., Галустян А. Н. Жидкая лекарственная форма Эргоферона — эффективное и безопасное средство лечения острых респираторных инфекций у детей… // Антибиотики и химиотерапия. 2014. № 5–6. С. 6–14.
-
[63] Hiltunen R., Josling P. D., James M. H. Preventing airborne infection with an intranasal cellulose powder formulation (Nasaleze travel) // Adv. Ther. 2007. Vol. 24. № 5. P. 1146–1153.
-
[64] Малахов А. Б., Снегоцкая М. Н., Дронов И. А. Совершенствование программ вакцинопрофилактики инфекционных заболеваний в России // Эффективная фармакотерапия. Педиатрия. 2011. № 2. С. 7–14.
-
[65] Lucero M. G., Dulalia V. E., Nillos L.T. et al. Pneumococcal conjugate vaccines for preventing vaccine-type invasive pneumococcal disease and X-ray defi ned pneumonia in children less than two years of age // Cochrane Database Syst. Rev. 2009. CD004977.
-
[66] Loo J. D., Conklin L., Fleming-Dutra K. E. et al. Systematic review of the eff ect of pneumococcal conjugate vaccine dosing schedules on prevention of pneumonia // Pediatr. Infect. Dis. J. 2014. Vol. 33. Suppl. 2. Р. 140–151.
-
[67] Myint T. T., Madhava H., Balmer P. et al. The impact of 7–valent pneumococcal conjugate vaccine on invasive pneumococcal disease: a literature review // Adv. Ther. 2013. Vol. 30. № 2. P. 127–151.
-
[68] Griffi n M. R., Zhu Y., Moore M. R. et al. U.S. hospitalizations for pneumonia after a decade of pneumococcal vaccination // N. Engl. J. Med. 2013. Vol. 36. № 2. Р. 155–163.
-
[69] Global action plan for prevention and control of pneumonia (GAPP) // WHO and UNICEF, 2009. 18 p.
Приложение A: Классификация пневмонии в соответствии с Международной классификацией болезней, травм и причин смерти 10–го пересмотра (1992)
J10.0 Грипп с пневмонией, вирус гриппа идентифицирован
J12 Вирусная пневмония, не классифицированная в других рубриках
J12.0 Аденовирусная пневмония
J13 Пневмония, вызванная Streptococcus pneumoniae
J14 Пневмония, вызванная Haemophilus infl uenzae
J15 Бактериальная пневмония, не классифицированная в других рубриках
J15.0 Пневмония, вызванная Klebsiella pneumoniae
J15.1 Пневмония, вызванная Pseudomonas
J15.2 Пневмония, вызванная стафилококком
J15.3 Пневмония, вызванная стрептококком группы B
J15.4 Пневмония, вызванная другими стрептококками
J15.5 Пневмония, вызванная Escherichia coli
J15.6 Пневмония, вызванная другими аэробными грамотрицательными бактериями
J15.7 Пневмония, вызванная Mycoplasma pneumoniae
J15.8 Другие бактериальные пневмонии
J15.9 Бактериальная пневмония неуточнённая
J16 Пневмония, вызванная другими инфекционными агентами, не классифицированными в других рубриках
J16.0 Пневмония, вызванная хламидиями
J16.8 Пневмония, вызванная другими уточнёнными инфекционными агентами
J17 Пневмония при болезнях, классифицированных в других рубриках
J17.0 Пневмония при бактериальных болезнях, классифицированных в других рубриках
J17.1 Пневмония при вирусных болезнях, классифицированных в других рубриках
J17.2 Пневмония при микозах
J17.3 Пневмония при паразитарных заболеваниях J17.8 Пневмония при других болезнях, классифицированных в других рубриках
J18 Пневмония без уточнения возбудителя
J18.0 Бронхопневмония неуточённая
J18.1 Долевая пневмония неуточённая
J18.2 Гипостатическая пневмония неуточнённая
J18.8 Другая пневмония, возбудитель не уточнен
J18.9 Пневмония неуточнённая
Приложение B: Правила регистрации случаев заболевания внебольничной пневмонией
Методические указания МУ 3.1.2.3047–13 «Эпидемиологический надзор за внебольничными пневмониями» (утв. Главным государственным санитарным врачом РФ 10 января 2013 г.)
О каждом случае заболевания ВП врачи всех медицинских организаций, независимо от организационно-правовых форм, в установленном порядке в течение 12 ч посылают экстренное извещение по установленной форме (ф. 058/у) в территориальную организацию Роспотребнадзора по месту выявления заболевания, указав диагноз и результаты исследования, на основании которых диагноз установлен.

Приложение C: Правила проведения бронхолитического теста
Оценку функции внешнего дыхания в условиях форсированного выдоха можно осуществлять у де тей в возрасте с 6 лет. Оценка показателей проводится по степени отклонения значений от должных величин, обычно учитывающих рост. Перед началом исследования обязательна калибровка оборудования. Необходимо учитывать факторы, влияющие на результат спирографии: степень кооперации, тренированность и тревожность пациента, выраженные нарушения осанки.
Тест проводится 3 раза стоя или сидя. Признаком правильной техники выполнения спирографического исследования является воспроизводимость результатов с разбросом значений менее 5%.
При нормальной функции легких отношение ОФВ1/ЖЕЛ и ОФВ1/ ФЖЕЛ составляет 85–95%. Любые значения ниже приведенных могут предполагать бронхиальн ую обструкцию. Увеличение ОФВ1 по крайней мере на 12% через 15 минут после ингаляции бронхолитика (200 мкг сальбутамола) говорит об обратимости бронхиальной обструкции. Для правильной оценки теста, если пациент получает бронхолитики, их необходимо до начала исследования отменить: β2-агонисты короткого действия — за 6 часов, β2-агонисты длительного действия — за 12 часов, пролонгированные теофиллины — за 24 часа. Дозы бронхолитиков при проведении теста:
-
сальбутамол (дозированный аэрозоль):
— детям до 7 лет— 100мкг;
— детям старше 7 лет — 200мкг;
-
беродуал Н (дозированный аэрозоль):
— детям до 7 лет — 1 доза;
— детям старше 7 лет — 2 дозы.
Ингаляции проводятся через спейсер.
Приложение D: Правила получения образца из респираторного тракта для культурального исследования
-
Мокрота собирается до применения антибактериальных препаратов.
-
Перед сбором мокроты детям старшего возраста необходимо почистить зубы, внутреннюю поверхность щек и язык, тщательно прополоскать рот кипяченой водой. Детям раннего возраста медсестра обрабатывает полость рта слабым антисептиком (тампоном, фиксированным зажимом), затем физиологическим раствором или кипяченой водой.
-
Затем при отсутствии кашля или сухом кашле провести ингаляцию физиологического раствора в течение 3–5 минут, проинструктировать ребенка о необходимости глубокого откашливания и собрать мокроту в стерильную емкость.
-
Детям раннего возраста проводят активный забор мокроты (трахеального аспирата) после вышеуказанных процедур с применением электроотсоса в стерильные одноразовые емкости.
-
Хранение проб не более 2 часов, при температуре +4…+8 °C, доставка в лабораторию в термоконтейнере.
Приложение E: Правила получения крови для культурального исследования
-
Для получения гемокультуры целесообразно использовать коммерческие флаконы с питательной средой. Минимально следует использовать две среды: «двойную среду» и «среду для контроля стерильности». При наличии бактериологических гемоанализаторов отбор образцов проводится в специальные флаконы согласно инструкции.
-
Информативный результат можно получить при взятии крови на высоте лихорадки в первые 1–3 дня заболевания и до применения антибиотиков.
-
Место венепункции обрабатывается вначале 70% этиловым спиртом, затем 1% раствором йода, затем вновь 70% этиловым спиртом.
-
После высыхания антисептика из вены отбирается не менее 5 мл у детей младшего возраста и 10 мл у школьников в стерильный шприц.
-
Оптимальное соотношение кровь/среда должно быть 1:5—1:10, для того, чтобы путем разведения крови преодолеть ее естественные бактерицидные свойства.
-
Транспортировка образцов в лабораторию осуществляется при комнатной температуре немедленно после их получения.
Приложение F: Дозы и режим применения пероральных антибактериальных препаратов при внебольничной пневмонии у детей
| Группа | МНН | Основные торговые наименования | Лекарственные формы | Суточная доза | Кратность приема в сутки | Примечания |
|---|---|---|---|---|---|---|
Аминопенициллины |
Амоксициллин |
Флемоксин Солютаб, Амоксициллин |
Таблетки диспергируемые, таблетки, капсулы, суспензия |
45–90 мг/кг |
2–3 раза |
Высокие дозы (80–90 мг/кг/сут) — для PRSP. При разделении суточной дозы на 3 приема эффективность выше |
ИЗАП |
Амоксициллин/ клавуланат |
Амоксиклав, Аугментин, Флемоклав Солютаб |
Таблетки диспергируемые, таблетки, суспензия |
45–90 мг/кг (по амоксициллину) |
||
Амоксициллин/ сульбактам |
Трифомокс ИБЛ |
Таблетки, суспензия |
||||
Сультамициллин |
Амписид |
Таблетки, суспензия |
25–50 мг/кг |
2 раза |
В организме превращается в ампициллин и сульбактам |
|
ЦС-2 |
Цефуроксим аксетил |
Зиннат |
Таблетки, суспензия |
20–30 мг/кг (не более 500 мг) |
2 раза |
Противопоказан детям до 3 мес. |
Цефаклор |
Цефаклор Штада, Цеклор |
Капсулы, суспензия |
20–40 мг/кг (не более 1500 мг) |
2–3 раза |
||
ЦС-3 |
Цефиксим |
Супракс, Супракс Солютаб |
Таблетки диспергируемые, капсулы, суспензия |
8 мг/кг |
1–2 раза |
|
Цефтибутен |
Цедекс |
Капсулы, суспензия |
9 мг/кг (не более 400 мг) |
1–2 раза |
Противопоказан детям до 6 мес. При пневмонии суточную дозу рекомендовано делить на 2 раза |
|
Макролиды |
Азитромицин |
Сумамед, Азитрокс, Хемомицин |
Капсулы, таблетки, суспензия |
10 мг/кг |
1 раз |
Противопоказан детям до 6 мес. |
Джозамицин |
Вильпрафен, Вильпрафен Солютаб |
Таблетки диспергируемые, таблетки |
40–50 мг/кг |
2–3 раза |
Противопоказан детям с массой тела менее 10 кг |
|
Кларитромицин |
Клацид, Фромилид |
Таблетки, суспензия |
15 мг/кг (не более 500 мг) |
1–2 раза |
Один раз в сутки принимаюся только таблетки пролонгированного действия |
|
Мидекамицин |
Макропен |
Таблетки, суспензия |
20–50 мг/кг |
2–3 раза |
||
Рокситромицин |
Рулид |
Таблетки диспергируемые, таблетки, капсулы |
5–8 мг/кг (не более 300 мг) |
2 раза |
||
Спирамицин |
Ровамицин, Спирамицин- Веро |
Таблетки |
150 000– 300 000 МЕ/кг |
2–3 раза |
Противопоказан детям до 3 лет (в форме таблеток) |
|
Эритромицин |
Эритромицин |
Таблетки |
30–50 мг/кг |
2–4 раза |
У детей до 3 мес суточная доза 20–40 мг/кг |
|
Линкозамиды |
Линкомицин |
Линкомицин |
Капсулы |
30–60 мг/кг |
2–3 раза |
Противопоказан детям до 2 лет |
Клиндамицин |
Далацин |
Капсулы |
8–25 мг/кг |
3–4 раза |
||
Тетрациклины |
Доксициклин |
Юнидокс Солютаб, Доксициклин |
Таблетки диспергируемые, таблетки, капсулы |
4 мг/кг или 4мг/кг в первый день, затем 2 мг/кг |
1–2 раза |
Противопоказан детям до 8 лет. |
Оксазолидиноны |
Линезолид |
Зивокс |
Таблетки, суспензия |
30 мг/кг |
3 раза |
Приложение G: Дозы и режим применения парентеральных антибактериальных препаратов при внебольничной пневмонии у детей
| Группа | Препарат | Основные торговые наименования | Путь введения | Суточная доза | Кратность введения в сутки | Примечания |
|---|---|---|---|---|---|---|
Природные пенициллины |
Бензилпенициллин |
Бензил-пенициллин, Пенициллин G |
В/в, в/м |
50000–500000 Ед/кг |
4–6 раз |
|
Аминопенициллины |
АмпициллинАмпициллин |
В/в, в/м |
50–200 мг/кг |
4 раза |
Изоксазолил- пенициллины |
|
Оксациллин |
Оксациллин |
В/в, в/м |
150–300 мг/кг |
4–6 раз |
ИЗАП |
|
Амоксициллин/клавуланат |
Амоксиклав, Аугментин |
В/в |
До 3 мес — 60 мг/кг (вес < 4 кг) или 90 мг/кг (вес > 4 кг), после 3 мес — 90–120 мг/кг (не более 4800 мг) |
3–4 раза (до 3 мес — 2–3 раза) |
Амоксициллин/ сульбактам |
|
Трифамокс ИБЛ |
В/в, в/м |
До 2 лет — 40–60 мг/кг, 2–6 лет — 750 мг, 6–12 лет — 1,5 г, После 12 лет — 2–3 г |
2–3 раза |
Ампициллин/сультактам |
||
Амписид, Сультасин |
В/в, в/м |
150 мг/кг |
3–4 раза |
ЦС-1 |
Цефазолин |
|
Цефазолин |
В/в, в/м |
20–100 мг/кг |
3–4 раза |
Противопоказан детям до 1 мес |
ЦС-2 |
Цефуроксим |
Зинацеф |
В/в, в/м |
30–100 мг/кг |
3 раза |
ЦС-3 |
Цефотаксим |
|
Клафоран, Цефотаксим |
В/в, в/м |
50–100 мг/кг |
3–4 раза |
Цефтриаксон |
||
Роцефин, Цефтриаксон |
В/в, в/м |
20–80 мг/кг |
1–2 раза |
Цефтазидим |
||
Фортум, Цефтазидим |
В/в, в/м |
30–150 мг/кг (не более 6 г), до 2 мес — 25–60 мг/кг |
2–3 раза |
Цефоперазон |
||
Цефобид |
В/в, в/м |
50–200 мг/кг2–3 раза |
Цефтриаксон/ сульбактам |
Броадсеф-С |
||
В/в, в/м |
20–80 мг/кг (по цефтриаксону) |
1–2 раза |
Цефоперазон/ сульбактам |
Сульперазон |
||
В/в, в/м |
40–160 мг/кг |
2–4 раза (до 1 мес — 2 раза) |
ЦС-4 |
Цефепим |
Максипим, цефепим |
|
В/в, в/м |
100–150 мг/кг |
2–3 раза |
Не рекомендуется у детей до 2 мес |
Карбапенемы |
Имипенем |
Тиенам |
В/в, в/м |
В/в — 60 мг/кг, в/м — 1–1,5 г |
В/в — 4 раза, в/м — 2 раза |
Противопоказан детям до 3 мес, форма для в/м — до 12 лет |
Меропенем |
Меронем |
|
В/в30–60 мг/кг |
3 раза |
Противопоказан детям до 3 мес |
Эртапенем |
Инванз |
В/в, в/м |
|
30 мг/кг (не более 1 г) |
2 раза (с 13 лет — 1 раз) |
Противопоказан детям до 3 мес |
Аминогликозиды |
Амикацин |
Амикацин |
В/в, в/м10–20 мг/кг |
1–2 раза |
Гентамицин |
Гентамицин |
В/в, в/м |
3–5 мг/кг |
||
1–2 раза |
Нетилмицин |
Нетромицин |
В/в, в/м |
4–6,5 мг/кг |
||
1–2 раза |
Тобрамицин |
Бруламицин Тобрамицин |
В/в, в/м |
3–5 мг/кг |
||
1–2 раза |
Макролиды |
Азитромицин |
Сумамед |
В/в |
10 мг/кг (не более 500 мг)* |
|
1 раз |
Противопоказан детям до 16 лет |
Эритромицин |
Эритромицин |
В/в |
30–50 мг/кг, до 3 мес — 20–40 мг/кг |
|
2–4 раза |
Линкозамиды |
Линкомицин |
Линкомицин |
В/в, в/м |
10–20 мг/кг |
|
3 раза |
Клиндамицин |
Далацин Ц |
В/в, в/м |
20–40 мг/кг |
||
3–4 раза |
Противопоказан детям до 3 лет |
Фторхинолоны |
Ципрофлоксацин |
Ципробай, Цифран, Ципролет |
В/в |
20–30 мг/кг (не более 1200 мг) |
2 –3 раза |
Противопоказан детям до 18 лет (разрешен для больных муковисцидозом) |
Респираторные фторхинолоны |
Левофлоксацин |
Таваник, Леволет |
В/в |
До 5 лет — 16–20 мг/кг, после 5 лет — 8–10 мг/кг* |
До 5 лет — 2 раза, после 5 лет — 1 раз |
Противопоказан детям до 18 лет |
Гликопептиды |
Ванкомицин |
Эдицин |
В/в |
40 мг/кг |
4 раза |
Оксазолидиноны |
Линезолид |
Зивокс |
В/в |
20 мг/кг |
* Дозировка приводится по зарубежным источникам [16], в связи с возрастными ограничениями в РФ.
Приложение H: Дозы и режим применения противовирусных препаратов при внебольничной пневмонии у детей
| МНН | Основные торговые наименования | Лекарственные формы | Суточная доза | Кратность приема в сутки | Примечания |
|---|---|---|---|---|---|
Осельтамивир |
Тамифлю |
Капсулы, суспензия |
<15 кг — 60 мг, 15–23 кг — 90 мг, 23–40 кг — 120 мг, >40 кг — 150 мг |
2 раза |
Противопоказан детям до 1 года. Курс лечения — 5 дней |
Занамивир |
Реленза |
Порошок для ингаляций |
10 мг (2 ингаляции) |
2 раза |
Противопоказан детям до 5 лет. Курс лечения — 5 дней |
Умифеновир |
Арбидол |
Таблетки, капсулы |
3–6 лет — 200 мг, 6–12 лет — 400 мг, после 12 лет — 800 мг |
4 раза |
Противопоказан детям до 3 лет |
Инозин пранобекс |
Гропринозин, Изопринозин |
Таблетки |
50 мг/кг |
3–4 раза |
Противопоказан детям до 2 лет |
Имидазолилэтанамид пентандиовой кислоты |
Ингавирин |
Капсулы |
13–17 лет — 60 мг |
1 раз |
Противопоказан детям до 13 лет* |
– |
Анаферон детский |
Таблетки для рассасывания |
1 сутки — 8 табл еток, затем 3 таблетки |
3–8 раза |
Курс лечения — 5 дней |
– |
Эргоферон |
Таблетки для рассасывания, раствор |
1 сутки — 8 таблеток или 40 мл, затем 3 таблетки или 15 мл |
3–8 раза |
Противопоказан детям до 6 мес. Курс лечения — 5 дней |
* Ожидается снижение возрастного ограничения до 6 лет.
9. СОКРАЩЕНИЯ
| АБП |
— антибактериальные препараты |
| АБТ |
— антибактериальная терапия |
| АГ |
— антиген |
| БА |
— бронхиальная астма |
| БАЛ |
— бронхоальвеолярный лаваж |
| БЛРС |
— β-лактамазы расширенного спектра |
| ВОЗ |
— Всемирная организация здравоохранения |
| ВП |
— внебольничная пневмония |
| ВПС |
— врожденный порок сердца |
| ДЦП |
— детский церебральный паралич |
| ИДС |
— иммунодефицитное состояние |
| ИЗАП |
— ингибиторзащищенный аминопенициллин |
| ИЛ |
— интерлейкин |
| МКБ |
— международная классификация болезней |
| МНН |
— международное непатентованное название |
| ОРВИ |
— острая респираторно-вирусная инфекция |
| ОРДС |
— острый респираторный дистресс-синдром |
| ОРИТ |
— отделение реанимации и интенсивной терапии |
| ПеГАС |
— многоцентровое исследование антимикробной резистентности пневмококка, гемофильной палочки, стрептококка группы А, моракселлы |
| ПКВ |
— пневмококковая конъюгированная вакцина |
| ППСВ |
— пневмококковая полисахаридная вакцина |
| ПКТ |
— прокальцитонин |
| РРО |
— Российское респираторное общество |
| РФ |
— Российская Федерация |
| СД |
— сахарный диабет |
| CРБ |
— С-реактивный белок |
| ЦС-2 |
— цефалоспорин 2-го поколения |
| ЦС-3 |
— цефалоспорин 3-го поколения |
| ЦС-4 |
— цефалоспорин 4-го поколения |
| ATS |
— Американское торакальное общество |
| ERS |
— Европейское респираторное общество |
| FiO2 |
— фракционная концентрация кислорода во вдыхаемом газе |
| PaO2 |
— парциальное давление кислорода в артериальной крови |
| SaO2 |
— насыщение (сатурация) артериальной крови кислородом |
10. СОКРАЩЕННЫЕ НАЗВАНИЯ МИКРООРГАНИЗМОВ
| ВИЧ |
— вирус иммунодефицита человека |
| ЦМВ |
— цитомегаловирус |
| B.pertussis |
— Bordetella pertussis |
| C.pneumoniae |
— Chlamydophila pneumoniae |
| C.psittaci |
— Clamydophila psittaci |
| H.infl uenzae |
— Haemophilus infl uenzae |
| K.pneumoniae |
— Klebsiella pneumoniae |
| L.pneumophila |
— Legionella pneumophila |
| M.catarrhalis |
— Moraxella catarrhalis |
| M.pneumoniae |
— Mycoplasma pneumonia |
| MRSA |
— methicillin-resistant (метициллин-резистентный) Staphylococcus aureus |
| MSSA |
— methicillin-sensitive (метициллин-чувствительный) Staphylococcus aureus |
| P.aeruginosa |
— Pseudomonas aeruginosa |
| P.jiroveci |
— Pneumocystis jiroveci |
| PRSP |
— penicillin-resistant (пенициллин-резистентный) Streptococcus pneumoniae |
| PSSP |
— penicillin- sensitive (пенициллин-чувствительный) Streptococcus pneumoniae |
| S.aureus |
— Staphylococcus aureus |
| S.agalactiae |
— Streptococcus agalactiae |
| S.pneumoniae |
— Streptococcus pneumoniae |