Утверждена на XVI Съезде педиатров России (февраль 2009 г.)
Москва, 2010
РУКОВОДИТЕЛИ ПРОГРАММЫ |
|
Баранов А.А. |
академик РАМН, профессор, директор Научный центр здоровья детей РАМН, Председатель Исполкома Союза педиатров России |
Тутельян А.В. |
академик РАМН, профессор, директор Научно-исследовательский институт питания РАМН, Председатель Национальной Ассоциации диетологов и нутрициологов |
КООРДИНАТОРЫ ПРОГРАММЫ |
|
Чумакова О.В. |
профессор, заместитель директора Департамента медико-социальных проблем семьи, материнства и детства Министерства здравоохранения и социального развития Российской Федерации |
Конь И.Я. |
академик РАЕН, профессор, руководитель Отдела детского питания Научно-исследовательский институт питания РАМН |
Боровик Т.Э. |
профессор, руководитель отделения питания здорового и больного ребенка Научный центр здоровья детей РАМН |
ЭКСПЕРТНЫЙ СОВЕТ: |
|
Абольян Л.В. |
д.м.н., руководитель Научно-практического центра по охране, поддержке и поощрению грудного вскармливания Минздравсоцразвития РФ |
Булатова Е.М. |
профессор кафедры поликлинической педиатрии Санкт-Петербургской государственной педиатрической медицинской академии, главный специалист по питанию детей Комитета по здравоохранению Правительства Санкт-Петербурга |
Болотова Н.В. |
профессор, заведующая кафедрой пропедевтики детских болезней, детской эндокринологии и диабетологии Саратовского государственного медицинского университета |
Вялкова А.А. |
профессор, заведующая кафедрой педиатрии Оренбургской медицинской академии Росздрава |
Гмошинская М.В. |
д.м.н., старший научный сотрудник Отдела детского питания Научно-исследовательский институт питания РАМН |
Грибакин С.Г. |
профессор кафедры питания детей и подростков Российской медицинской академии последипломного образования Росздрава |
Жданова Л.А |
профессор, заведующая кафедрой педиатрии Ивановской государственной медицинской академии Росздрава |
Захарова И.Н. |
профессор, заведующая кафедрой педиатрии Российской медицинской академии последипломного образования Росздрава |
Захарова Н.И. |
профессор кафедры акушерства и гинекологии с курсом перинатологии Российского университета дружбы народов |
Ильин А.Г. |
д.м.н., руководитель научно-организационного отдела Научный центр здоровья детей РАМН |
Коровина Н.А. |
профессор кафедры педиатрии Российской медицинской академии последипломного образования Росздрава |
Ладодо К.С. |
член-корреспондент РАЕН, профессор, главный научный сотрудник Научный центр здоровья детей РАМН |
Мазанкова Л.Н. |
профессор, заведующая кафедрой детских инфекционных болезней Российской медицинской академии последипломного образования Росздрава |
Мальцев С.В. |
профессор, заведующий кафедрой педиатрии Казанской государственной медицинской академии |
Мухина Ю.Г. |
профессор, заведующая кафедрой педиатрии № 2 с курсом гастроэнтерологии и нутрициологии Российского государственного медицинского университета |
Нетребенко О.К. |
профессор кафедры педиатрии № 2 с курсом гастроэнтерологии и нутрициологии Российского государственного медицинского университета |
Санникова Н.Е. |
профессор, заведующая кафедрой пропедевтики детских болезней Уральской медицинской академии |
Сорвачева Т.Н. |
профессор, заведующая кафедрой питания детей и подростков Российской медицинской академии последипломного образования Росздрава |
Тимофеева А.Г. |
к.м.н., Ученый секретарь Научный центр здоровья детей РАМН |
Фурцев В.И. |
к.м.н., доцент кафедры детских болезней Красноярской государственной медицинской академии |
Хавкин А.И. |
профессор, заведующий отделением лечебно-профилактической помощи Московского НИИ педиатрии и детской хирургии Минздравсоцразвития РФ |
Яцык Г.В. |
академик РАЕН, профессор, д.м.н. главный научный сотрудник Научный центр здоровья детей РАМН |
ОТВЕТСТВЕННЫЙ СЕКРЕТАРЬ |
|
Скворцова В.А. |
д.м.н., ведущий научный сотрудник Научный центр здоровья детей РАМН |
Шилина Н.Н. |
ведущий научный сотрудник НИИ питания РАМН |
ПРЕДПОСЫЛКИ ДЛЯ ИЗМЕНЕНИЯ РЕКОМЕНДАЦИЙ ПО ПИТАНИЮ ДЕТЕЙ ПЕРВОГО ГОДА ЖИЗНИ
В связи с изменением экологической, экономической ситуации, а также ухудшением состояния здоровья детского населения России за последние 10 лет назрела необходимость в изменении рекомендаций по питанию детей грудного возраста.
Результаты научных исследований, проведенных в последние годы, показывают, что питание ребенка оказывает влияние не только на его рост, развитие и состояние здоровья. Стало очевидным, что питание на первом году жизни «программирует» метаболизм таким образом, что те или иные нарушения питания могут увеличить риск развития целого ряда заболеваний: таких как аллергические болезни, ожирение, метаболический синдром, остеопороз и некоторые другие. Следует отметить, что все эти заболевания называют в настоящее время «эпидемией» цивилизации, что подтверждается ростом частоты случаев, тяжестью течения и многочисленными неблагоприятными последствиями.
Существование метаболического программирования было доказано вначале для детей, родившихся недоношенными или с внутриутробной гипотрофией. Клинические исследования больших когорт детей выявили, что низкий вес при рождении с высокой степенью достоверности способствует ранней артериальной гипертензии, а также формированию инсулин-резистентности в возрасте 20–30 лет.
Новые научные исследования позволили продемонстрировать, что такие же осложнения наблюдаются у детей, имеющих на первом году жизни высокую скорость роста. Определена ее взаимосвязь с искусственным вскармливанием, при котором потреблением белка и калорий выше, чем при естественном. Однако какие возрастные периоды формируют метаболические нарушения (первые 6 мес. ?, первые 12 мес. ? или первые 24 мес. ?) пока точно установить не удалось.
Существует несколько гипотез по связи избыточной прибавки массы тела с развитием в последующем метаболического синдрома. Первая предполагает связь повышенного потребления белка с детскими смесями с увеличением уровня «инсулиногенных» аминокислот в плазме крови и ростом секреции инсулина и инсулиноподобного фактора роста 1 (IGF-1), обладающих адипогенным действием. Снижение уровня белка в современных смесях приводило к уменьшению уровня IGF-1 и таким образом, снижало риск развития ожирения.
Вторая гипотеза связывает избыточное питание и быстрый рост с нарушением формирования гипоталамогипофизарной оси и снижением чувствительности ядер гипоталамуса к лептину, что нарушает регуляцию аппетита и энерготраты. Вполне вероятно, что оба этих механизма действуют одновременно, усиливая и поддерживая нарушения метаболизма.
К настоящему времени доказано, что избыточная прибавка массы тела у детей первого года жизни сопровождается более высоким накоплением жира при снижении белковой составляющей массы тела, нарушением чувствительности клеток к инсулину и уменьшением плотности костной ткани, что является предпосылкой к развитию ожирения и остеопороза во взрослой жизни.
Грудное вскармливание позволяет предупредить развитие ожирения и метаболического синдрома в дальнейшей жизни.
В последние десятилетия все чаще появляется информация о росте аллергических, аутоиммунных заболеваний и других состояний, связанных с нарушением функции иммунной системы.
Развитие аллергической сенсибилизации в младенчестве свидетельствует о неспособности организма выработать толерантность к пищевому антигену. В этом процессе принимают участие различные звенья врожденного и приобретенного иммунитета, и отсутствие толерантности свидетельствует о нарушении адекватного развития иммунной системы ребенка.
Появившиеся в последние годы данные позволяют предположить, что в становлении иммунитета в постнатальном периоде важную роль играет адекватная кишечная микрофлора, поскольку именно она является первичным стимулом для активации врожденного и развития приобретенного иммунитета. Наиболее благоприятными и значимыми для младенца являются бифидобактерии.
Препятствием к нормальной колонизации кишечника у младенца являются современные строгие гигиенические нормы ведения родов, отсроченное прикладывание к груди, отсутствие грудного вскармливания. Нарушают естественную колонизацию кишечника оперативное родоразрешение, использование антибактериальной терапии.
Грудное вскармливание с первого дня жизни снижает риск развития аллергии не только на первом году жизни, но и в дальнейшем.
В настоящее время питание детей первого года жизни в РФ во многих случаях является неадекватным и характеризуется недостаточной распространенностью грудного вскармливания, ранним введением в питание неадаптированных молочных смесей, неоптимальными сроками назначения и ассортиментом продуктов прикорма.
По данным Минздравсоцразвития РФ в 2008 г в Российской Федерации доля детей, находившихся на грудном вскармливании к числу детей, достигших 1 года, составляет от 3 до 6 мес. — 40,8%, от 6 до 12 мес. — 39,3% (рис. 1).
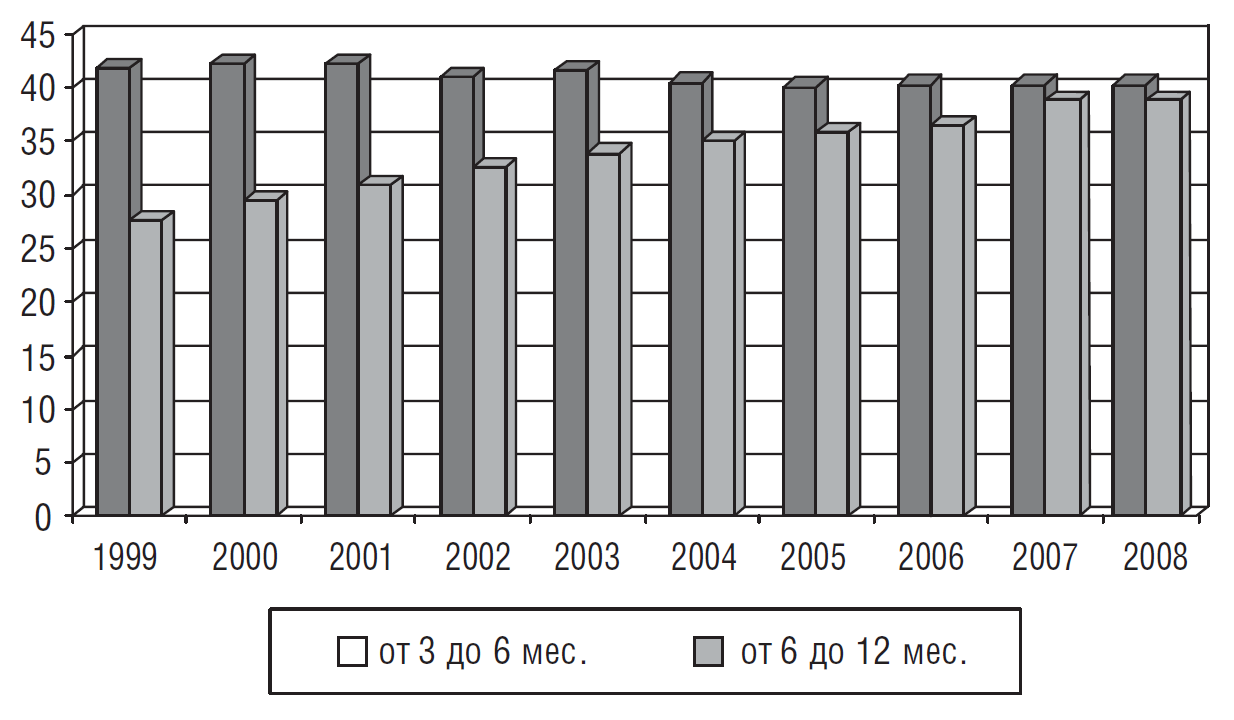
Проведенные в основных регионах Российской Федерации многоцентровые исследования свидетельствуют о том, что искусственное вскармливание с рождения получали 2,5% детей, в возрасте 1 мес. — 11,6%, в 2 мес. в 18,5%, в 3 мес. — 26,2% (табл. 1).
| Возраст детей, мес | Распространенность искусственного вскармливания |
|---|---|
0 |
2,5 |
1 |
11,6 |
2 |
18,5 |
3 |
28,2 |
4 |
32,0 |
5 |
37,6 |
6 |
46,1 |
При анализе данных об особенностях организации прикорма детям выявлены отклонения в последовательности и сроках введения продуктов и блюд прикорма по сравнению с действующими методическими указаниями «Современные принципы и методы вскармливания детей первого года жизни, МЗ РФ, №225, 1999» (табл. 2).
| Продукты и блюда прикорма | Средние сроки введения | Рекомендуемые сроки введения продуктов и блюд прикорма МЗ РФ, 1999 г |
|---|---|---|
Плодоовощные соки |
4,3 |
3 |
Фруктовые пюре |
4,6 |
3 |
Каши |
6 |
5 |
Овощное пюре |
5,5 |
4 |
Мясо |
7,2 |
7 |
Молоко |
7,3 |
8 |
Кефир |
6,9 |
8 |
Творог |
6,5 |
5 |
Желток яичный |
6,5 |
6 |
Рыба |
7,5 |
8 |
Ряд отклонений в сроках введения прикорма, учитывая изменившиеся представления об оптимальном питании, являются положительными, в частности более позднее введение фруктовых соков и пюре. К числу неблагоприятных тенденций следует отнести факт раннего введения в питания детей кефира и цельного коровьего молока, которые в ряде случаев используются уже с 3–4 месяцев, а также позднее назначение мясного пюре (нередко с 8–9 мес.). Другой особенностью организации прикорма является относительно более позднее введение в питание творога и яичного желтка, что вероятно следует признать целесообразным.
Необходимо отметить, что в табл. 2 представлены усредненные данные, однако разброс их очень велик, что отражает неадекватность питания.
Установлено частое использование продуктов домашнего приготовления. Вместе с тем преимущество продуктов промышленного производства не вызывает сомнения, учитывая их гарантированные состав, качество, безопасность и высокую пищевую ценность (табл. 3).
| Виды продуктов и блюд прикорма | Только промышленного производства, % | Только домашнего приготовления, % |
|---|---|---|
Плодоовощные соки |
16–66 |
1–47 |
Фруктовые пюре |
9–34 |
6–47 |
Каши |
19–40 |
11–51 |
Овощное пюре |
13–32 |
6–47 |
Молоко |
Молочная кухня 6–46 |
Магазин 1–34 |
Кефир |
Молочная кухня 5–47 |
Магазин 5–60 |
Творог |
5–35 |
21–74 |
Мясное пюре |
11–35 |
17–55 |
Нарушения в организации вскармливания детей первого года жизни являются одной из причин значительной распространенности таких алиментарно-зависимых заболеваний как, анемия, гипо- и паротрофия, рахит, пищевая аллергия и служит преморбидным фоном для возникновения и хронического течения заболеваний желудочно- кишечного тракта, болезней органов дыхания, сердечно-сосудистой системы и др. Динамика распространенности алиментарно-зависимых заболеваний за 5 лет по данным статистического анализа Минздравсоцразвития РФ представлена в табл. 4.
Заболевания |
Годы |
||||
2002 |
2003 |
2004 |
2005 |
2006 |
|
Анемия |
39,2 |
46,2 |
49,84 |
50,44 |
46,62 |
Рахит II–III степени |
29,3 |
51,97 |
50,97 |
55,31 |
51,05 |
Расстройства питания |
35,5 |
38,5 |
38,29 |
37,03 |
32,51 |
Все это свидетельствует о необходимости проведения дальнейшей работы по организации поддержки грудного вскармливания путем более активного внедрения Инициативы ВОЗ/ЮНИСЕФ по охране и поддержке грудного вскармливания и опыта российских педиатров в работу родовспомогательных служб и детских лечебно-профилактических учреждений, принятию «Правил маркетинга заменителей грудного молока в учреждениях здравоохранения Российской Федерации», адресной помощи дополнительным питанием беременным и кормящим женщинам из социально незащищенных семей.
Назрела необходимость оптимизации сроков и последовательности введения продуктов прикорма в зависимости от продолжительности грудного вскармливания и состояния здоровья ребенка.
Целесообразно систематизировать новые данные в области диетотерапии различных заболеваний у детей грудного возраста.
В связи с этим представляется чрезвычайно важным и актуальным создание и реализация Национальной программы «Оптимизация питания детей первого года жизни в Российской Федерации», которая позволит объективно оценить сложившуюся ситуацию с питанием детей, на основании полученных данных разработать и внедрить в широкую практику здравоохранения современные рекомендации по питанию здоровых и больных детей грудного возраста.
Цель программы:
Оптимизация питания детей первого года жизни как один из ключевых подходов к улучшению состояния здоровья детского населения Российской Федерации.
Основные задачи программы:
-
внедрение современных организационных технологий по поощрению, поддержке и охране грудного вскармливания в работу родовспогательных служб и детских лечебно-профилактических учреждений РФ
-
разработка подходов к оптимизации питания беременных женщин и кормящих матерей, включая использование адресной помощи.
-
оптимизация сроков введения и ассортимента продуктов и блюд прикорма, совершенствование методов профилактики и диетотерапии алиментарно-зависимых заболеваний, функциональных нарушений пищеварения, пищевой аллергии, синдрома нарушенного кишечного всасывания, острых кишечных инфекций, отдельных видов наследственной патологии у детей первого года жизни
-
разработка единой программы обучения и совершенствования знаний по вопросам питания здоровых и больных детей первого года жизни для студентов высших медицинских учебных заведений, врачей-педиатров и организаторов здравоохранения
-
разработать «Правила маркетинга заменителей грудного молока в учреждениях здравоохранения Российской Федерации» на основе Международного свода правил маркетинга заменителей грудного молока (1981)
-
разработка, утверждение и внедрение нормативно методических документов по организации питания здоровых и больных детей, беременных и кормящих женщин
-
совершенствование нормативно-методических документов по статистической отчётности с использованием показателей, обеспечивающих получение наиболее полных и достоверных представлений о существующей практике организации питания детей первого года жизни
ОЖИДАЕМЫЕ РЕЗУЛЬТАТЫ:
-
повышение знаний врачей-педиатров, неонатологов, акушеров-гинекологов по вопросам питания здоровых и больных детей первого года жизни, беременных женщин и кормящих матерей, за счет широкого внедрения данной программы в практическое здравоохранение.
-
внесение изменений в обучающие программы медицинских ВУЗов по вопросам организации детского питания
-
увеличение распространенности грудного вскармливания в Российской Федерации на 25–30%
-
снижение распространенности алиментарно-зависимой патологии среди детей раннего возраста на 15%, за счет оптимизации их питания, включающего использование современных продуктов промышленного производства, обогащенных витаминно-минеральными комплексами, пре- и пробиотиками, нуклеотидами, длинноцепочечными жирными кислотами
-
улучшение состояния здоровья детей грудного и раннего возраста за счет снижения уровня заболеваемости и предупреждения инвалидизации путем внедрения современных технологий организации рационального и лечебно-профилактического питания.
До настоящего времени в России подобного рода программы не разрабатывались.
1. ПИТАНИЕ БЕРЕМЕННЫХ ЖЕНЩИН
Питание женщины во время беременности призвано обеспечить правильное течение, благоприятной исход беременности и поддерживать оптимальное состояние здоровья женщины, тем самым способствовать нормальному формированию, росту и развитию плода.
Неправильное питание в период беременности наряду с другими причинами может привести к тяжелым последствиям — выкидышу, преждевременным родам, рождению ребенка с различными внутриутробными дефектами, отставанию в физическом и нервно-психическом развитии.
Дефицит отдельных макро- и микронутриентов во внутриутробном периоде влияет не только на формирование плода, но и отрицательно сказывается на дальнейшем состоянии здоровья ребенка и является фактором риска развития целого ряда заболеваний в зрелом возрасте (табл. 5).
| Дефицитные состояния | Нарушения развития плода |
|---|---|
Белково-энергетический дефицит |
Внутриутробная гипотрофия, задержка развития головного мозга |
Дефицит длинноцепочечных полиненасыщенных жирных кислот, нарушение соотношения w-3 и w-6 ПНЖК |
Нарушение развития ткани головногомозга и сетчатки глаза. Отставание в росте, кожные нарушения, нарушения репродуктивной функции, жировая дегенерация печени, нарушение когнитивных функций |
Дефицит фолиевой кислоты |
Дефекты развития нервной трубки (мозговая грыжа, анэнцефалия и др.), замедленный рост энтероцитов |
Дефицит витамина А |
Врожденные пороки развития |
Дефицит йода |
Нарушение нервно-психического развития (при тяжелых формах — врожденный кретинизм) |
В последние годы большое внимание уделяется достаточному поступлению цинка в период беременности. В экспериментальных исследованиях при его дефиците выявлен выраженный тератогенный эффект: аномалии развития мозга, расщелина верхней челюсти, аномалии развития сердца, легких, мочеполовой системы. Дефицит цинка оказывает влияние на развитие эмбриона и плода посредством нескольких механизмов, включающих снижение клеточной пролиферации, снижение синтеза белка, увеличение активности свободно-радикальных процессов, клеточного апоптоза.
Дефицит цинка у беременной женщины сопровождается снижением иммунного ответа, повышенной заболеваемостью, увеличивает частоту осложнений беременности и рецидивов хронических заболеваний.
Недостаточная обеспеченность железом беременных женщин увеличивает риск преждевременных родов. Дефицит железа отрицательно влияет на иммунный ответ и увеличивает риск инфекции; при этом снижается активность фагоцитов и нейтрофилов и уменьшается бактерицидное действие клеток киллеров (NK). Для предупреждения развития железодефицитных состояний возможно использование соков «ФрутоНяня» для двоих «Профилактика анемии», обогащенные лактатом железа («Яблоко», «Яблоко-груша», «Яблоко-морковь») (ОАО «ПРОГРЕСС», Россия).
Следует отметить, что помимо железа иммунный ответ определяют и другие эссенциальные микроэлементы и их дефицит также предрасполагает к развитию инфекционных заболеваний (табл. 6)
| Микроэлемент | Влияние дефицита |
|---|---|
Железо |
Снижение цитотоксической активности фагоцитов и пролиферации Т1-лимфоцитов |
Цинк |
Снижение пролиферации и функциональной активности Т-лимфоцитов |
Селен |
Снижение продукции антител, синтеза цитокинов, пролиферации лимфоцитов |
Медь |
Снижение фагоцитарной активности, продукции антител. Пролиферации Т-лимфоцитов и числа В-клеток |
Таким образом, обеспечение беременных женщин адекватным количеством всех эссенциальных микронутриентов играет важную роль в нормальном течении беременности, предупреждении преждевременных родов и благоприятном нутритивном статусе новорожденного ребенка.
Однако опасен не только дефицит, но и избыточное потребление некоторых микронутриентов, особенно витамина А, отличающегося токсичностью в больших дозах.
Питание женщины во время беременности должно быть полноценным и разнообразным, полностью соответствуя физиологическим потребностям в пищевых веществах и энергии как самой женщины, так и растущего плода с учетом срока гестации. Рекомендуется сохранение пищевых стереотипов, сформированных у женщин до наступления беременности (если питание женщины было достаточно адекватным). Все это будет способствовать обеспечению комфортного самочувствия, хорошего настроения и высокой активности беременной женщины.
В первом триместре беременности, когда плод еще невелик, а женщина продолжает вести обычный образ жизни, потребности в основных пищевых веществах и энергии существенно не меняются и соответствуют рекомендуемым физиологическим нормам для женщин детородного возраста. Во втором и третьем триместре беременности, когда плод достигает больших размеров, для его нормального развития, а также для роста плаценты, матки, грудных желез требуется дополнительное количество энергии, белка, кальция, железа, витаминов (табл. 7). Для адекватной моторной активности кишечника необходимо дополнительное поступление пищевых волокон.
| Пищевые вещества и энергетическая ценность рациона | Базовая потребность женщины 18–29 лет | Дополнительная потребность при беременности | Всего при беременности |
|---|---|---|---|
Энергия, ккал |
2200 |
350 |
2550 |
Белки, г |
66 |
30 |
96 |
в т.ч. животного происхождения, г |
33 |
20 |
56 |
Жиры, г |
73 |
12 |
86 |
Углеводы, г |
318 |
30 |
348 |
Минеральные вещества |
|||
Кальций, мг |
1000 |
300 |
1300 |
Фосфор, мг |
800 |
200 |
1000 |
Магний, мг |
400 |
50 |
450 |
Железо, мг |
18 |
15 |
33 |
Цинк, мг |
12 |
3 |
15 |
Йод, мкг |
150 |
70 |
220 |
Витамины |
|||
С, мг |
90 |
10 |
100 |
А, мкг ретинол, экв. |
900 |
100 |
1000 |
Е, мг |
15 |
2 |
17 |
D, мкг |
10 |
2,5 |
12,5 |
В1, мг |
1,5 |
0,2 |
1,7 |
В2, мг |
1,8 |
0,2 |
2,0 |
В6, мг |
2,0 |
0,3 |
2,3 |
РР, мг ниацин, экв. |
20 |
2 |
22 |
Фолат, мкг |
400 |
200 |
600 |
В12, мкг |
3 |
0,5 |
3,5 |
Указанные количества пищевых веществ и энергии в основном обеспечиваются соответствующим набором продуктов (табл. 8).
| Продукты | Количество |
|---|---|
Хлеб пшеничный |
120 |
Хлеб ржаной |
100 |
Мука пшеничная |
15 |
Крупы, макаронные изделия |
60 |
Картофель |
200 |
Овощи |
500 |
Фрукты свежие |
300 |
Соки |
150 |
Фрукты сухие |
20 |
Сахар |
60 |
Кондитерские изделия |
20 |
Мясо, птица |
170 |
Рыба |
70 |
Молоко, кефир и др. кисломолочные продукты 2,5% жирности |
500 |
Творог 9% жирности |
50 |
Сметана 10% жирности |
15 |
Масло сливочное |
25 |
Масло растительное |
15 |
Яйцо |
0,5 шт. |
Сыр |
15 |
Чай |
1 |
Кофе |
3 |
Соль |
5 |
Химический состав рационов: |
|
Белки, г |
96 |
в т.ч. животные, г |
60 |
Жиры, г |
90 |
в т.ч. растительные., г |
23 |
Углеводы, г |
340 |
Энергетическая ценность, ккал |
2556 |
Учитывая высокую потребность беременных женщин в витаминах и тот факт, что их содержание в натуральных продуктах недостаточно, особенно в зимне-весенний период, цесообразно назначать витаминно-минеральные комплексы, предназначенные для беременных женщин или специализированные обогащенные продукты.
С этой целью могут использоваться «Витрум пренатал/форте», «Мадонна» в гранулах, «Матерна», «Мультитабс перинатал», «Копмливит Мама», «Прегнавит», «Теравит», «Элевит Пронаталь» и др. Подбор осуществляется индивидуально. При выборе поливитаминного препарата следует обращать внимание на содержание отдельных составляющих и их концентраций. Так, некоторые препараты не содержат йода, а концентрация железа может отличаться в 4 раза. При повышенном содержании витамина А (от 300 до 500% суточной нормы) продолжительность курса должна быть ограничена.
В питании беременных следует также использовать специализированные продукты, обогащенные витаминами и минеральными веществам. Умеренный уровень внесения витаминов и минеральных веществ (30% суточной потребности) позволяет использовать такие продукты на протяжении всего периода беременности и лактации. Особо нуждаются в назначении продуктов данной группы беременные женщины с недостаточным и нерациональным питанием, страдающие хроническими заболеваниями, анемией, а также при наличии тяжелых гестозов, многоплодной беременности (табл. 9).
| Химический состав | «Фемилак» (Нутритек, Россия) | «МDМил Мама» (HOCHDORF Nutritec AG, Швейцария) | «АГУ МАМА» (витаминизированное молоко) (Вимм-Билль-Данн, Россия) | «Аннамария прима» (Fasska, Бельгия) | «Дамил МАМАм» (Кофранлэ, Франция) | «Мадонна» (Валетек, Россия) | «Амалтея» (CBMBV, Голландия) |
|---|---|---|---|---|---|---|---|
Белки, г |
4,5 |
4,3 |
2,6–2,8 |
5,0 |
4,8 |
5,1 |
3,0 |
Жиры, г |
3,1 |
2,2 |
3,5–2,5 |
1,0 |
1,0 |
0,3 |
3,7 |
Углеводы, г |
10,0 |
10,1 |
4,7 |
11,2 |
10,6 |
16,0 |
4,3 |
Витамины |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
Минеральные вещества |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
Энергетическая ценность, ккал |
90 |
80 |
53–62 |
72 |
68 |
85 |
63 |
Основа продукта |
Коровье молоко |
Коровье молоко |
Коровье молоко |
Коровье молоко |
Коровье молоко |
Изолят соевого белка |
Козье молоко |
2. ПИТАНИЕ КОРМЯЩИХ МАТЕРЕЙ [3]
В период кормления грудью питание женщины необходимо организовывать с учетом поддержания ее здоровья, обеспечения достаточной и продолжительной лактации при оптимальном составе грудного молока. Питание кормящей матери должно удовлетворять ее физиологические потребности в пищевых веществах и энергии, а также возрастные потребности ребенка первых месяцев жизни.
В табл. 10 представлены рекомендуемые нормы потребности в энергии, белков, жиров, углеводов, минеральных веществ и витаминов в различные периоды лактации.
| Энергия и пищевые вещества | Базовая потребность женщины в возрасте 18–29 лет | Дополнительно в первые 6 мес лактации | Дополнительно после 6 мес лактации |
|---|---|---|---|
Энергия, ккал |
2200 |
500 |
450 |
Белки |
66 |
40 |
30 |
в т.ч. животного происхождения, г |
33 |
26 |
20 |
Жиры, г |
73 |
15 |
15 |
Углеводы, г |
318 |
40 |
30 |
Минеральные вещества |
|||
Кальций, мг |
1000 |
400 |
400 |
Фосфор, мг |
800 |
200 |
200 |
Магний, мг |
400 |
50 |
50 |
Железо, мг |
18 |
0 |
0 |
Цинк, мг |
12 |
3 |
3 |
Йод, мкг |
150 |
140 |
140 |
Витамины |
|||
С, мг |
90 |
30 |
30 |
А, мкг ретинол. экв. |
900 |
400 |
400 |
Е, мг |
15 |
4 |
4 |
D, мкг |
10 |
2,5 |
2,5 |
В1, мг |
1,5 |
0,3 |
0,3 |
В2, мг |
1,8 |
0,3 |
0,3 |
РР, мг ниац, экв. |
20 |
3 |
3 |
Фолат, мкг |
400 |
100 |
100 |
В12, мкг |
3 |
0,5 |
0,5 |
Рекомендуемые количества пищевых веществ и энергии в основном обеспечиваются соответствующим набором продуктов (табл. 11).
| Продукты | Количество |
|---|---|
Хлеб пшеничный |
150 |
Хлеб ржаной |
100 |
Мука пшеничная |
20 |
Крупы, макаронные изделия |
70 |
Картофель |
200 |
Овощи |
500 |
Фрукты |
300 |
Соки |
150 |
Фрукты сухие |
20 |
Сахар |
60 |
Кондитерские изделия |
20 |
Мясо, птица |
170 |
Рыба |
70 |
Молоко, кефир и др. кисломолочные продукты 2,5% жирности |
600 |
Творог 9% жирности |
50 |
Сметана 10% жирности |
15 |
Масло сливочное |
25 |
Масло растительное |
15 |
Яйцо |
0,5 шт. |
Сыр |
15 |
Чай |
1 |
Кофе |
3 |
Соль |
8 |
Химический состав рационов: |
|
Белки, г |
104 |
в т.ч. животные, г |
60 |
Жиры, г |
93 |
в т.ч. растительные., г |
25 |
Углеводы, г |
370 |
Энергетическая ценность, ккал |
2735 |
Для улучшения состава рационов кормящих женщин, достаточной выработки грудного молока и оптимизации его состава могут использоваться продукты для беременных и кормящих женщин (табл. 9), а также витаминизированные соки и напитки, дополнительно обогащенные основными витаминами (например, сок «ФрутоНяня» для двоих, «Для улучшения лактации», обогащенные лактатом кальция («Яблоко-груша», «Яблоко-персик» (ОАО «ПРОГРЕСС», Россия). Наиболее целесообразно назначение специальных продуктов для кормящих матерей, в состав которых введены травы, обладающие лактогонным действием (табл. 12).
| Пищевые вещества | Лактамил, Нутритек, Россия | Млечный путь, ООО «Витапром», Россия |
|---|---|---|
Белки, г |
4,5 |
3,8 |
Жиры, г |
3,1 |
1,3 |
Углеводы, г |
10,4 |
5,6 |
Витамины |
+ |
+ |
Минеральные вещества |
+ |
+ |
Энергетическая ценность, ккал |
88,0 |
50,0 |
Добавки |
Сбор трав: крапива, анис, тмин, фенхель |
Трава галега |
Применяются также специальные травяные чаи с экстрактами лактогонных трав (табл. 13)
| Продукты | Фирмы | Добавки |
|---|---|---|
Травяные чаи для кормящих матерей |
Тёма (Россия) |
Анис, итальянский укроп, тимьян, тмин, мелисса, крапива, галега |
ХиПП (Австрия) |
Укроп, тмин, крапива, мелисса |
|
Даниа (Дания) |
Укроп, тмин, крапива, мелисса, галега |
|
Хумана (Германия) |
Фенхель, гибискус, галега, пажитник, вербена, ройбос |
Таким образом, рационально организованное питание беременных женщин и кормящих матерей, построенное с учетом рекомендуемых норм физиологических потребностей в макро- и микронутриентах и энергии, обеспечиваемых соответствующими наборами продуктов, использованием витаминно-минеральных комплексов или специализированных продуктов нутритивного и лактогонного действия, обогащенных витаминами и минеральными веществами безусловно, позволит поддержать здоровье женщины и обеспечить адекватное развитие, как плода, так и грудного ребенка.
3. ЕСТЕСТВЕННОЕ ВСКАРМЛИВАНИЕ [4]
Рациональное вскармливание детей грудного возраста является залогом их адекватного роста и развития, а также высокого качества жизни, как в раннем детском возрасте, так и в последующие годы.
Состав женского молока
Оптимальным продуктом питания для ребенка первых месяцев жизни является материнское молоко, соответствующее особенностям его пищеварительной системы и обмена веществ, обеспечивающее адекватное развитие детского организма при рациональном питании кормящей женщины. Все нутриенты женского молока легко усваиваются, поскольку их состав и соотношение соответствуют функциональным возможностям желудочно-кишечного тракта грудного ребенка, а также благодаря наличию в женском молоке ферментов (амилазы, липазы, фосфатазы, протеаз и др.) и транспортных белков. Грудное молоко является источником гормонов и различных факторов роста (эпидермального, инсулиноподобного и др.), которые играют важнейшую роль в регуляции аппетита, метаболизма, роста и дифференцировки тканей и органов ребенка.
За счет присутствия антител, иммунных комплексов, активных лейкоцитов, лизоцима, макрофагов, секреторного иммуноглобулина А, лактоферрина и других биологически активных веществ грудное молоко повышает защитные функции детского организма. лигосахариды, а также низкие уровни белка и фосфора в женском молоке способствуют росту здоровой кишечной микрофлоры. В последние годы бифидо- и лактобактерии, определяющие становление иммунитета, обнаружены непосредственно в женском молоке (рис. 2).
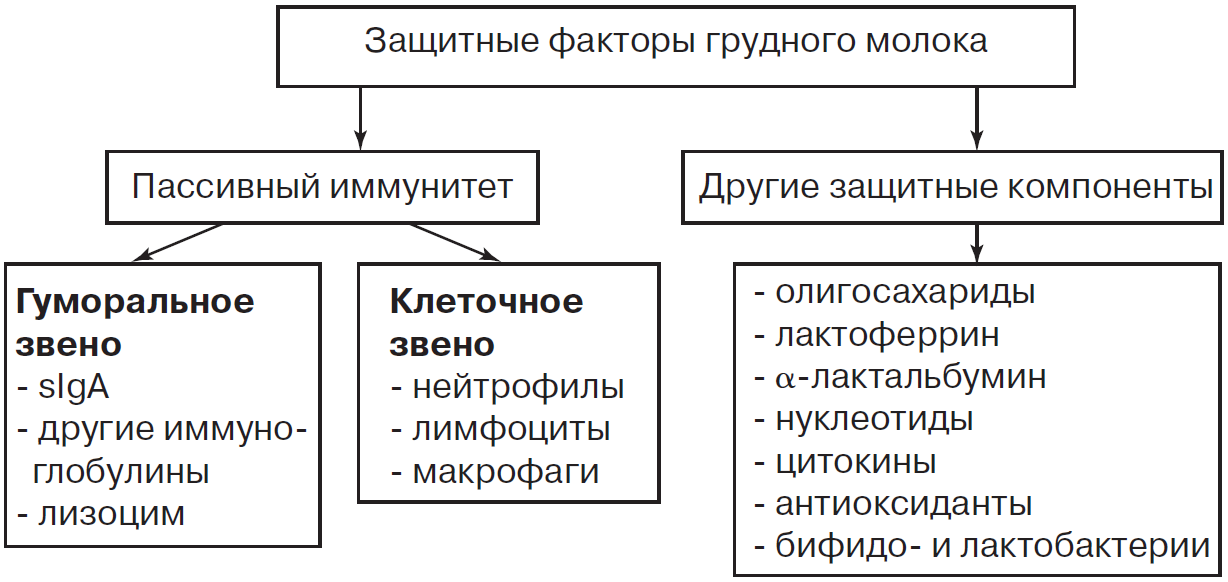
Поэтому дети, находящиеся на естественном вскармливании, значительно реже болеют инфекционными заболеваниями, развивают более стойкий поствакцинальный иммунитет.
Протективные свойства женского молока не ограничиваются только противоинфекционной защитой. Грудное вскармливание снижает риск развития в последующие годы таких заболеваний, как атеросклероз, гипертоническая болезнь, сахарный диабет, ожирение, лейкозы и др. У детей на грудном вскармливании реже регистрируются случаи внезапной смерти.
Естественное вскармливание оказывает благоприятное влияние на развитие центральной нервной системы ребенка и его психический статус. Единение матери и ребенка в процессе кормления грудью оказывает глубокое взаимное эмоциональное воздействие. Отмечено, что дети, которые вскармливались материнским молоком, отличаются гармоничным физическим развитием, они более спокойны, уравновешены, приветливы и доброжелательны по сравнению с детьми, находившимися на искусственном вскармливании, а впоследствии сами становятся внимательными и заботливыми родителями.
По некоторым данным у детей, получавших грудное вскармливание, выше коэффициент интеллектуального развития, что, возможно, отчасти связано и с наличием в грудном молоке длинноцепочечных полиненасыщенных жирных кислот (ДПНЖК), необходимых для развития клеток головного мозга и сетчатки. В крови детей, находящихся на грудном вскармливании, количество ДПНЖК достоверно выше, по сравнению с детьми, получающими искусственное вскармливание.
Белок женского молока состоит в основном из сывороточных протеинов (70–80%), содержащих незаменимые аминокислоты в оптимальном для ребенка соотношении, и казеина (20–30%). Белковые фракции женского молока подразделяются на метаболизируемые (пищевые) и неметаболизируемые белки (иммуноглобулины, лактоферрин, лизоцим и др.), которые составляют 70–75% и 25–30% соответственно.
В женском молоке в отличие от коровьего молока присутствует большое количество альфа-лактальбумина (25–35%), который богат эссенциальными и условно эссенциальными аминокислотами (триптофан, цистеин). Альфа-лактальбумин способствует росту бифидобактерий, усвоению кальция и цинка из желудочно-кишечного тракта ребенка.
В составе женского молока присутствуют нуклеотиды, на долю которых приходится около 20% всего небелкового азота. Нуклеотиды являются исходными компонентами для построения рибонуклеиновой и дезоксирибонуклеиновой кислот, им принадлежит важная роль в поддержании иммунного ответа, стимуляции роста и дифференцировки энтероцитов.
Основными компонентами жира женского молока являются триглицериды, фосфолипиды, жирные кислоты, стеролы. Его жирнокислотный состав характеризуется относительно высоким содержанием незаменимых полиненасыщенных жирных кислот (ПНЖК), концентрация которых в женском молоке в 12–15 раз больше, чем в коровьем. ПНЖК — предшественники арахидоновой, эйкозапентаеновой и докозагексаеновой жирных кислот, являющихся важным компонентом клеточных мембран, из них образуются различные классы простагландинов, лейкотриенов и тромбоксанов, они необходимы также для миелинизации нервных волокон и формирования сетчатки глаз.
Длинноцепочечные полиненасыщенные жирные кислоты — арахидоновая и докозогексаеновая содержатся в женском молоке в небольшом количестве (0,1–0,8% и 0,2–0,9% от общего содержания жирных кислот, соответственно), но существенно более высоком, чем в коровьем молоке.
Жиры материнского молока перевариваются легче, чем коровьего, так как они в большей степени эмульгированы, кроме того в грудном молоке содержится фермент липаза, участвующая в переваривании жирового компонента молока, начиная с ротовой полости.
Содержание холестерина в женском молоке относительно высоко и колеблется от 9 до 41 мг%, стабилизируясь к 15 суткам лактации на уровне 16–20 мг%. У детей на естественном вскармливании отмечается более высокий уровень холестерина, чем при использовании детских молочных смесей. Холестерин необходим для формирования клеточных мембран, тканей нервной системы и ряда биологически активных веществ, включая витамин D.
Углеводы женского молока представлены в основном дисахаридом b-лактозой (80–90%), олигосахаридами (15%). В отличие от a-лактозы коровьего молока, b-лактоза женского молока медленно расщепляется в тонкой кишке ребенка, частично доходит до толстой кишки, где метаболизируется до молочной кислоты, способствуя росту бифидо- и лактобактерий. Лактоза способствует лучшему усвоению минеральных веществ (кальция, цинка, магния и др.).
Олигосахариды — углеводы, включающие от 3 до 10 остатков моносахаридов, которые не подвергаются расщеплению ферментами пищеварительного тракта, не всасываются в тонкой кишке и в неизмененном виде достигают просвета толстой кишки, где ферментируются, являясь субстратом для роста бифидобактерий. При этом происходит конкурентное торможение развития условно патогенной флоры. Кроме того, олигосахариды женского молока имеют рецепторы для бактерий, вирусов (ротавирусов), токсинов и антител, блокируя тем самым их связывание с мембраной энтероцита. Рассмотренные функции олигосахаридов, а также лактозы, лежат в основе пребиотических эффектов женского молока, в значительной мере определяя его протективное действие в отношении кишечных инфекций у детей грудного возраста.
Минеральный состав женского молока значительно отличается от коровьего, в котором содержится в 3 раза больше солей, в основном, за счет макроэлементов. Относительно низкое содержание минеральных веществ в женском молоке обеспечивает его низкую осмолярность и уменьшает нагрузку на незрелую выделительную систему. К макроэлементам относятся кальций, фосфор, калий, натрий, хлор и магний. Остальные минеральные вещества являются микроэлементами и присутствуют в тканях организма человека в малых количествах. Десять из них в настоящее время отнесены к классу эссенциальных: железо, цинк, йод, фтор, медь, селен, хром, молибден, кобальт и марганец.
Минеральные вещества поступают в организм с пищей и водой, а выделяются — с мочой, калом, потом, слущенным эпителием и волосами.
Предполагается, что железо, кальций, магний, цинк усваиваются существенно лучше из женского молока, чем из коровьего. Это объясняется прежде всего их оптимальным соотношением с другими минеральными веществами (в частности кальция с фосфором, железа с медью и др.). Высокую биодоступность микроэлементов обеспечивают также транспортные белки женского молока, в частности, лактоферрин — переносчик железа, церулоплазмин — меди. Невысокий уровень железа в женском молоке компенсируется его высокой биодоступностью (до 50%).
Недостаточность микроэлементов, являющихся регуляторами обменных процессов, сопровождается снижением адаптационных возможностей и иммунологической защиты ребенка, а выраженный их дефицит приводит к развитию патологических состояний: нарушению процессов построения костного скелета и кроветворения, изменению осмотических свойств клеток и плазмы крови, снижению активности целого ряда ферментов.
В женском молоке присутствуют все водо- и жирорастворимые витамины. Концентрация витаминов в молоке во многом определяется питанием кормящей матери и приемом поливитаминных препаратов. Следует подчеркнуть, однако, что уровень витамина D в женском молоке крайне низок, что требует его дополнительного назначения детям, находящимся на естественном вскармливании.
Дефицит витаминов приводит к нарушениям ферментативной активности, гормональным дисфункциям, снижению антиоксидантных возможностей организма ребенка. У детей чаще наблюдается полигиповитаминоз, реже встречается изолированный дефицит одного микронутриента.
Состав женского молока изменяется в процессе лактации, особенно на протяжении первых дней и месяцев кормления грудью, что позволяет наиболее полно обеспечить потребности грудного ребенка. Небольшой объем молока (молозива) в первые дни лактации компенсируется относительно высоким содержанием белка и защитных факторов, в последующие недели концентрация белка в женском молоке снижается и в дальнейшем остается практически неизменной. Наиболее лабильный компонент женского молока — жир, уровень которого зависит от его содержания в рационе кормящей матери и изменяется как во время каждого кормления, нарастая к его окончанию, так и в течение дня. Углеводы — более стабильная составляющая женского молока, но их уровень тоже изменяется во время кормления, будучи максимальным в первых порциях молока.
Организация естественного вскармливания
В родильном доме с целью становления достаточной по объему и продолжительности лактации здоровый новорожденный ребенок должен выкладываться на грудь матери в первые 30 минут после не осложненных родов на срок не менее, чем на 30 минут.
АРГУМЕНТАЦИЯ ЭТОГО МЕТОДА ВКЛЮЧАЕТ В СЕБЯ СЛЕДУЮЩИЕ ПОЛОЖЕНИЯ:
-
Раннее прикладывание ребенка к груди матери обеспечивает быстрое включение механизмов секреции молока и более устойчивую последующую лактацию;
-
Сосание ребенка способствует энергичному выбросу окситоцина и тем самым уменьшает опасность кровопотери у матери, способствует более раннему сокращению матки;
-
Контакт матери и ребенка:
— оказывает успокаивающее действие на мать, исчезает стрессорный гормональный фон;
— способствует через механизмы импринтинга усилению чувства материнства, увеличения продолжительности грудного вскармливания;
— обеспечивает получение новорожденным материнской микрофлоры.
Объем молозива в первые сутки очень мал, но даже капли молозива крайне важны для новорожденного ребенка. Оно обладает рядом уникальных свойств:
-
содержит больше иммуноглобулинов, лейкоцитов и других факторов защиты, чем зрелое молоко, что в значительной степени предохраняет ребенка от интенсивного бактериального обсеменения, уменьшает риск гнойно-септических заболеваний;
-
оказывает мягкий слабительный эффектом, благодаря этому кишечник ребенка очищается от мекония, а вместе с ним и от билирубина, что препятствует развитию желтухи;
-
способствует становлению оптимальной микрофлоры кишечника, уменьшает длительность фазы физиологического дисбактериоза;
-
содержит факторы роста, которые оказывают влияние на созревание функций кишечника ребенка.
Для получения ребенком молозива в максимально возможном объеме частота прикладываний к груди не должна регламентироваться. С целью осуществления свободного вскармливания по требованию здоровый ребенок должен находиться в одной палате с матерью. Показано, что при свободном вскармливании объём лактации выше, чем при вскармливании по часам. Раннее прикладывание к груди и «свободное вскармливание» являются ключевыми факторами обеспечения полноценной лактации и способствуют установлению тесного психоэмоционального контакта между матерью и ребёнком.
В начале становления лактации очень важно избежать раздражения и трещин сосков, которые затрудняют процесс кормления. При их возникновении должны использоваться только специально предназначенные для решения этой проблемы средства, обладающие подтвержденной безопасностью для ребенка даже при попадании в рот (бальзам для сосков Mustela 9 Months).
Для поддержания лактации особенно значимы ночные кормления, так как ночью уровень пролактина более высокий. Длительность прикладывания к груди здорового ребенка в первые дни не должна ограничиваться, даже когда он практически ничего не высасывает, а дремлет у груди. Потребность в контакте и сосании может носить самостоятельный характер, относительно независимый от пищевого поведения. Однако в дальнейшем чрезмерно частое прикладывание ребенка к груди матери при его малейшем беспокойстве может привести к перекорму. В связи с этим одной из важных задач педиатров, в особенности участковых, является обучение матери дифференцировке «голодного» крика ребёнка от крика, обусловленного другими причинами: младенческими коликами, дискомфортом, переменой обстановки, перегреванием или охлаждением ребенка, болью и др.
Оценка адекватности лактации требует тщательного анализа поведения ребенка, характера стула, частоты мочеиспусканий. Вероятными признаками недостаточной лактации являются:
-
беспокойство и крик ребенка во время или сразу после кормления;
-
необходимость в частых прикладываниях к груди;
-
длительное кормление, при котором ребенок совершает много сосательных движений, при отсутствии глотательных;
-
ощущение матерью быстрого полного опорожнения грудных желез при активном сосании ребенка, при сцеживании после кормлений молока нет;
-
беспокойный сон, частый плач, «голодный» крик;
-
скудный редкий стул.
Однако наиболее достоверными признаками недостаточного питания являются низкая прибавка массы тела и редкие мочеиспускания (менее 6 раз за сутки) с выделением небольшого количества концентрированной мочи. Окончательный вывод о недостаточной лактации может быть сделан на основании результатов взвешивания ребенка в домашних условиях после каждого кормления в течение суток («контрольное» взвешивание).
В отдельных случаях даже при достаточном количестве молока мать не может накормить ребенка грудью:
-
ребенок берет грудь, но не сосет, не глотает или сосет очень мало;
-
при попытке матери дать грудь ребенок кричит и сопротивляется;
-
после непродолжительного сосания отрывается от груди, давясь от плача;
-
ребенок берет одну грудь, но отказывается от другой.
Причины могут быть разными, среди которых наиболее распространенными являются:
-
нарушения организации и техники вскармливания (неправильное положение ребенка у груди);
-
избыток молока у матери, при котором оно течет слишком быстро;
-
прорезывание зубов,
-
заболевания ребенка (перинатальное поражение нервной системы, частичная лактазная недостаточность, гастроинтестинальная форма пищевой аллергии, острая респираторно-вирусная инфекция, отит, молочница, стоматит и др.).
Выяснение причины и проведение при необходимости своевременного лечения помогают сохранить полноценное грудное вскармливание.
Гипогалактия истинная (или первичная) встречается редко, не более чем у 5% женщин. В остальных случаях снижение выработки молока вызвано различными причинами, основными из которых являются: отсутствие у женщины доминанты лактации (психологического настроя) в связи с плохой подготовкой в период беременности, а также эмоциональный стресс, раннее и необоснованное введение докорма детскими смесями, необходимость выхода на работу, болезнь ребенка, болезнь матери и т.д.
В ряде случаев гипогалактия носит транзиторный характер, проявляясь в виде так называемых лактационных кризов, под которыми понимают временное уменьшение количества молока, возникающее без видимой причины. Отсутствие информации о них и не знание методов коррекции — наиболее частые факторы прекращения грудного вскармливания.
В основе лактационных кризов лежат особенности гормональной регуляции лактации. Они обычно возникают на 3–6 неделях, 3, 4, 7, 8 месяцах лактации. Продолжительность лактационных кризов в среднем составляет 3–4 дня, и они не представляют опасности для здоровья ребёнка. В таких случаях оказывается достаточным более частое прикладывание ребенка к груди в сочетании с кормлением из обеих грудей. Необходим покой и отдых матери; разнообразное, полноценное, с высокими вкусовыми качествами питание; тёплое питьё напитков особенно с использованием лактогонных трав или препаратов за 15–20 мин до кормления, а также специальных продуктов лактогонного действия.
Если мать заранее не подготовлена к такой ситуации, то при первых признаках снижения лактации она пытается докормить ребёнка смесями. Поэтому одной из важных задач участкового врача и медсестры детской поликлиники является разъяснение безопасности кратковременных лактационных кризов.
Мероприятия, применяемые при вторичной гипогалактии (лактационных кризах):
-
более частые прикладывания к груди;
-
урегулирование режима и питания матери (включая оптимальный питьевой режим за счет дополнительного использования не менее 1 литра жидкости в виде чая, компотов, воды, соков);
-
воздействие на психологический настрой матери;
-
ориентация всех членов семьи (отца, бабушек, дедушек) на поддержку грудного вскармливания;
-
контрастный душ на область молочных желёз, мягкое растирание груди махровым полотенцем;
-
использование специальных напитков, обладающих лактогонным действием;
При этом детские молочные смеси в питание ребёнка без рекомендаций врача не вводятся.
Многочисленные наблюдения показывают, что достаточная выработка грудного молока в основном зависит от «настроя матери» на кормление своего ребенка грудью, ее убежденности в том, что это важно и необходимо и что она способна это осуществить.. Более успешное становление лактации и её продолжение проходят в условиях, когда кроме желания и уверенности матери, её активно поддерживают все члены семьи, а также профессиональные консультации и практическая помощь медицинских работников. Целесообразно, чтобы обучение женщин вопросам грудного вскармливания происходило во время беременности в «Школе беременных».
Важнейшая роль в пропаганде грудного вскармливания отводится врачам и медицинским сестрам, которые должны активно поощрять семейную и социальную поддержку грудного вскармливания, обеспечивать родителей полной информацией о его всестороннем положительном влиянии на организм ребенка и преимуществах перед детскими смесями. Для осуществления деятельности по успешному становлению и поддержанию практики естественного вскармливания, все медицинские работники, имеющие отношение к родовспоможению и медицинскому наблюдению за детьми грудного возраста, должны обладать способностями оказания практической помощи матери по грудному вскармливанию.
В соответствии с международной программой ВОЗ/ЮНИСЕФ «Охрана, поощрение и поддержка практики грудного вскармливания», где изложены основные положения в виде десяти принципов успешного грудного вскармливания, Министерством здравоохранения Российской Федерации была разработана программа поддержки грудного вскармливания и утвержден ряд нормативно-методических документов (1994, 1996, 1998, 1999, 2000 гг). Согласно этим документам, в лечебно-профилактических учреждениях родовспоможения и детства рекомендуется проводить следующую работу по поддержке естественного вскармливания:
-
иметь доступную печатную информацию, касающуюся практики грудного вскармливания, которую следует регулярно доводить до сведения всего медицинского персонала;
-
информировать всех беременных женщин о преимуществах грудного вскармливания и необходимости раннего прикладывания новорожденного ребенка к груди матери (в течение первых 30 минут после родов);
-
обеспечивать круглосуточное совместное пребывание матери и ребёнка в палате «мать и дитя» родильного дома и поощрять грудное вскармливание по требованию ребенка;
-
обучать матерей технике кормления ребенка грудью и сохранения лактации;
-
стремиться к проведению в течение первых 4–6 месяцев жизни исключительно грудного вскармливания, то есть, не давать здоровым новорожденным детям никакой пищи, кроме грудного молока, за исключением случаев, обусловленных медицинскими показаниями;
-
обеспечивать преемственность в работе женской консультации, акушерского стационара, детской поликлиники и детского стационара.
Эти мероприятия необходимо проводить с учетом состояния здоровья, как матери, так и ребенка.
Возможными противопоказаниями к грудному вскармливанию со стороны матери являются: эклампсия, сильные кровотечения во время родов и в послеродовом периоде, открытая форма туберкулеза, состояние выраженной декомпенсации при хронических заболеваниях сердца, легких, почек, печени, а также гипертиреоз, острые психические заболевания, особо опасные инфекции (тиф, холера и др.), герпетические высыпания на соске молочной железы (до их долечивания), ВИЧ-инфицирование.
В настоящее время установлено, что ВИЧ — инфицированная женщина с вероятностью в 15% заражает ребёнка через грудное молоко. В связи с этим в Российской Федерации детей рожденных от ВИЧ инфицированных матерей рекомендуется кормить адаптированными смесями.
При таких заболеваниях кормящей матери как краснуха, ветряная оспа, корь, эпидемический паротит, цитомегаловирусная инфекция, простой герпес, острые кишечные и острые респираторно-вирусные инфекции, если они протекают без выраженной интоксикации, кормление грудью при соблюдении правил общей гигиены не противопоказано. Наличие гепатита В и С у женщин в настоящее время не является противопоказанием к грудному вскармливанию, однако кормление осуществляют через специальные силиконовые накладки. При остром гепатите А у матери кормление грудью запрещается.
При маститах грудное вскармливание продолжается. Однако оно временно прекращается при обнаружении массивного роста в грудном молоке золотистого стафилококка в количестве 250 КОЕ и более в 1 мл и единичных колоний представителей семейства Enterobacteriacae или вида Pseudomonas aeruginosa (Методические рекомендации по бактериологическому контролю грудного молока, Москва, 1984). Абсцесс молочной железы является возможным осложнением мастита и наиболее вероятен при резком прерывании кормления грудью. Кормление из здоровой железы должно продолжаться, а молоко из инфицированной груди следует осторожно сцеживать и выливать.
Прекращают кормление грудью в тех случаях, когда мать принимает цитостатики в терапевтических дозах, иммунносупрессивные препараты, антикоагулянты типа фениндиона, радиоизотопные контрастные вещества для лечения или обследования, препараты лития, большинство противовирусных препаратов (кроме ацикловира, зидовудина, занамивира, лимовудина, озельтамивира — с осторожностью), противогельминтные препараты, а также некоторые антибиотики: макролиды (кларитромицин, мидекамицин, рокситромицин, спирамицин), тетрациклины, хинолоны и фторхинолоны, гликопептиды, нитроимидазолы, хлорамфеникол, ко-тримоксазол. Однако препараты альтернативные перечисленным антибиотикам не противопоказаны для кормления грудью.
Обычно безопасны, используемые в средних дозах короткие курсы парацетамола, ацетилсалициловой кислоты, ибупрофена; большинство противокашлевых лекарств; антибиотики — ампициллин и другие пенициллины, эритромицин; противотуберкулезные препараты (кроме рифабутина и ПАСК); противогрибковые средства (кроме флуконазола, гризеофульвина, кетоконазола, интраконазола); антипротозойные препараты (кроме метронидазола, тинидазола, дигидроэметина, примахина); бронходилятаторы (сальбутамол); кортикостероиды; антигистаминные препараты; антациды; противодиабетические средства; большинство гипотензивных препаратов, дигоксин, а также разовые дозы морфина и других наркотических средств. Вместе с тем во время приёма медикаментозных препаратов матерью, необходимо внимательное наблюдение за ребенком с целью своевременного обнаружения их побочных эффектов.
Возможно угнетение лактации при приеме женщиной эстрогенов, включая эстрогенсодержащие контрацептивы, диуретиков тиазодового ряда, эргометрина.
Перевод ребенка грудного возраста, особенно новорожденного, на искусственное вскармливание из-за медикаментозного лечения матери лекарственными препаратами в терапевтической дозировке несёт в себе определенную угрозу для состояния его здоровья и качества жизни.
Учитывая негативное воздействие табачного дыма, смолы и никотина на организм ребенка и на лактацию, курящим женщинам в период лактации рекомендуется отказаться от курения. Никотин может снижать обьём вырабатываемого молока и тормозить его выделение, а также вызывать у ребёнка раздражительность, кишечные колики и приводить к низким темпам нарастания массы тела в грудном возрасте. У курящих женщин ниже уровень пролактина, что может сократить период лактации, а также снижена концентрация витамина С в грудном молоке по сравнению с некурящими. Следует формировать у курящих женщин мотивацию на отказ от курения или, по крайней мере, значительное снижение числа выкуренных сигарет. Содержание вредных веществ в грудном молоке будет меньше, если женщина выкуривает сигарету после кормления грудью, а не до него.
Не должны кормить ребенка грудью матери, страдающие алкогольной и наркотической (героин, морфин, метадон или их производные) зависимостью.
Кормление грудью во время наступления новой беременности может продолжаться.
Противопоказания к раннему прикладыванию к груди матери со стороны ребенка — оценка состояния новорожденного по шкале Апгар ниже 7 баллов при тяжелой асфиксии новорожденного, родовой травме, судорогах, синдроме дыхательных расстройств, а также глубокая недоношенность, тяжелые пороки развития (желудочно-кишечного тракта, челюстно-лицевого аппарата, сердца, и др.).
К числу противопоказаний к раннему прикладыванию ребенка к груди матери до самого последнего времени относилось также родоразрешение путем операции кесарево сечение. Однако если данная операция проводится под перидуральной анестезией прикладывание ребенка к груди в родовом зале возможно. Если родоразрешение проводилось под наркозом, то после окончания операции родильница переводится в палату интенсивной терапии роддома, а младенец — в детскую палату послеродового отделения. Через несколько часов (не более 4-х) после окончания действия наркоза детская сестра приносит новорожденного к матери и помогает ей приложить его к груди. В течение первых суток это повторяют несколько раз. На вторые сутки, при удовлетворительном состоянии матери и младенца, они воссоединяются в послеродовом отделении совместного пребывания матери и ребенка.
При ряде тяжелых врожденных пороков развития (пороки сердца с декомпенсацией, волчья пасть, заячья губа и др.), когда прикладывание к груди невозможно, ребенок должен получать сцеженное материнское молоко.
Абсолютные противопоказания к грудному вскармливанию со стороны ребенка на последующих этапах лактации очень ограничены — наследственные энзимопатии (галактоземия и др.). При фенилкетонурии объем грудного молока в сочетании с лечебными продуктами устанавливается индивидуально.
Следует остановиться на вопросах допаивания детей, находящихся на исключительно грудном вскармливании. Практика отечественных педиатров показывает, что новорожденные и дети более старшего возраста, находящиеся на грудном вскармливании иногда нуждаются в жидкости. Такое состояние может быть связано с пониженной влажностью в квартире, повышенной температурой окружающей среды, обильной жирной пищей, съеденной матерью накануне и пр. В этих ситуациях можно предложить ребенку воду из ложки, и если он начал охотно пить, то значит нуждался в ней. Кроме того, допаивание необходимо больным детям, особенно при заболеваниях сопровождающихся высокой лихорадкой, диарей, рвотой, гипербилирубинемией. В остальных случаях дети, находящиеся на исключительно грудном вскармливании, не нуждаются в допаивании.
В настоящее время существует более 50 заболеваний, которые у детей в периоде новорожденности могут проявляться желтушным окрашиванием кожи. Поэтому длительное сохранение желтухи у новорожденного требует обязательного обследования.
Даже при выраженной физиологической желтухе у детей в первые дни жизни нельзя отказываться от грудного вскармливания. Раннее прикладывание ребенка к груди и частые кормления являются важным фактором профилактики желтухи, поскольку молозиво, обладая слабительным эффектом, приводит к более быстрому отхождению мекония. При недостаточном питании новорожденного ребенка желтуха может быть более интенсивной и длительной в связи со сгущением желчи. Допаивание водой или растворами глюкозы не способствует профилактике желтухи, но снижает степень ее выраженности. Важно чтобы ребенок получал адекватное количество молока, поскольку при недостаточном питании развивается синдром сгущения желчи.
Желтуха, связанная с грудным вскармливанием — желтуха от материнского молока или желтуха Ариаса развивается у 1–4% детей после первой недели жизни, характеризуется повышением уровня несвязанного билирубина и не влияет на состояние ребенка. Патогенез изучен недостаточно, предполагается связь с различными компонентами грудного молока. Получить подтверждение диагноза можно, прекратив прикладывание ребенка к груди и используя для кормления пастеризованное материнское молоко в течение 1–2-х суток. За это время интенсивность желтухи значительно уменьшается и можно продолжить грудное вскармливание.
Ребенка с гипербилирубинемией, обусловленной несовместимостью по АВ0, целесообразно кормить грудью с рождения, поскольку антитела, содержащиеся в молоке разрушаются соляной кислотой и ферментами пищеварительной системы. При резус конфликте, если ребенку не проводилось заменное переливание крови, то его в течение первых 10–14 дней кормят пастеризованным (во время пастеризации антитела разрушаются) материнским или донорским молоком. В случаях проведения заменного переливания крови, через 3–5 часов после операции ребенка можно приложить к груди.
Грудное вскармливание целесообразно продолжать до 1–1,5 лет, причем частота прикладываний ребенка к груди после года уменьшается до 1–3 раз в сутки.
4. СМЕШАННОЕ И ИСКУССТВЕННОЕ ВСКАРМЛИВАНИЕ [5]
Введение докорма или полный перевод ребёнка на искусственное вскармливание должны быть строго обоснованными и могут осуществляться только в том случае, когда весь арсенал средств, направленных на профилактику гипогалактии и стимуляцию лактации, оказывается неэффективным.
Под смешанным вскармливанием в нашей стране понимают кормление ребенка первого года жизни грудным молоком в количестве не менее 1/5 суточного объема (150–200 мл) в сочетании с детскими молочными смесями. При искусственном вскармливании грудное молоко либо полностью отсутствует, либо его доля составляет менее 1/5 суточного рациона ребенка, а в качестве замены женского молока используются его заменители.
Перевод ребенка на искусственное вскармливание, особенно в первые месяцы жизни для него далеко не безразличен, являясь своеобразным «метаболическим стрессом». Ни одна даже самая современная искусственная смесь не может являться полноценной заменой материнского молока. В связи с этим большое внимание врачей и среднего медицинского персонала должно уделяться правильному выбору «заменителей» женского молока с учетом индивидуальных особенностей здоровья, физического развития и аппетита.
В соответствии с Федеральным законом РФ от 12 июня 2008 г. № 88-ФЗ «Технический регламент на молоко и молочную продукцию» адаптированными молочными смесями (заменителями женского молока) — называют пищевые продукты в жидкой или порошкообразной форме, изготовленные на основе коровьего молока, молока других сельскохозяйственных животных, предназначенные для использования в качестве заменителей женского молока и максимально приближенные к нему по химическому составу с целью удовлетворения физиологических потребностей детей первого года жизни в пищевых веществах и энергии.
Последующие молочные смеси — адаптированные (максимально приближенные к составу женского молока) или частично адаптированные (частично приближенные к составу женского молока) смеси на основе коровьего молока, молока других сельскохозяйственных животных, предназначенные для вскармливания детей старше 6 месяцев жизни в сочетании с продуктами прикорма.
В питании детей первого года жизни преимущество отдается адаптированным молочным смесям, созданным с учетом современных требований к их составу. Существует несколько видов адаптированных молочных смесей (рис. 3):
-
«начальные» или «стартовые» смеси — для детей первых 6 месяцев жизни;
-
«последующие» смеси» — для детей второго полугодия жизни;
-
смеси от «0 до 12 месяцев» — могут применяться на протяжении всего первого года жизни ребенка.
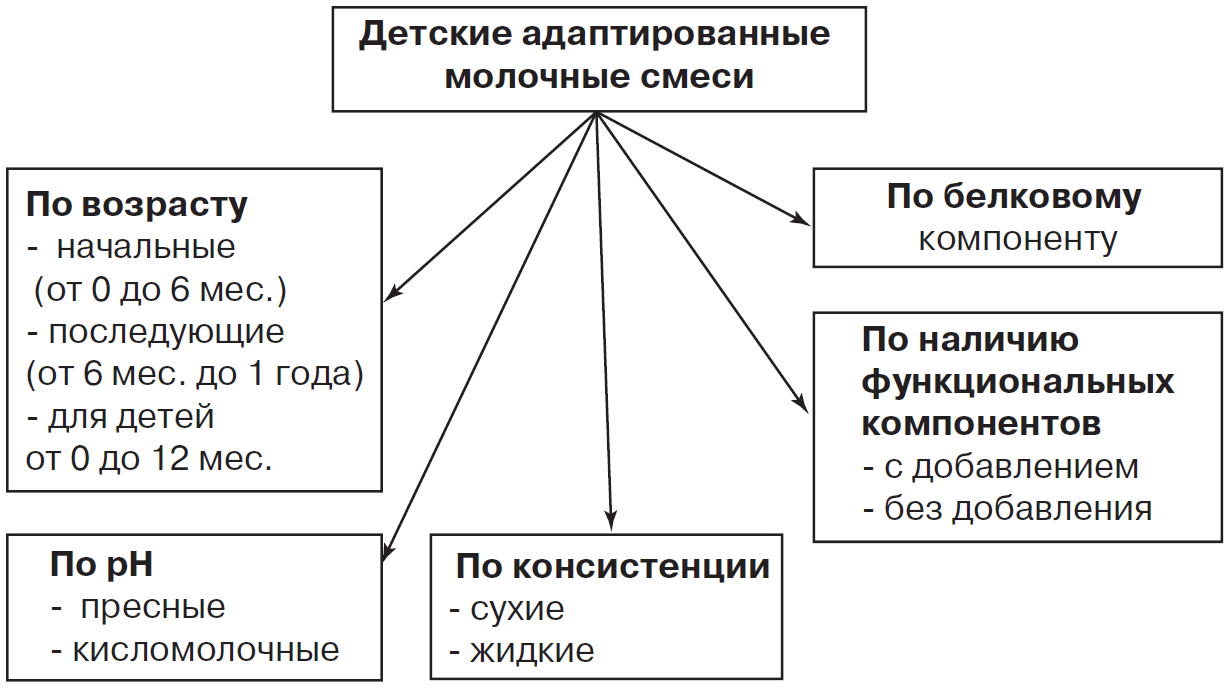
Состав «начальных» смесей максимально адаптирован к физиологическим потребностям и особенностям обмена веществ и пищеварения детей первого полугодия жизни. В последнее время наблюдается тенденция к снижению уровня белка в современных молочных продуктах с целью его количественного приближения к таковому в женском молоке. Это стало возможным благодаря улучшению качества белкового компонента. Так, в большинстве «начальных» смесей количество белка составляет 1,4–1,6 г/100 мл, а минимальный уровень — 1,2 г/100 мл (содержание белка в 100 мл зрелого женского молока составляет 0,9–1,2 г).
Белковый компонент таких продуктов представлен легкоусвояемыми сывороточными белками (с полным набором заменимых и незаменимых аминокислот) и казеином в соотношении 60:40, 50:50, в отдельных смесях 70:30. Все адаптированные молочные смеси обогащены таурином, в состав некоторых дополнительно введены отдельные аминокислоты и a-лактальбумин. Все большее количество искусственных смесей содержит в своем составе нуклеотиды.
Жировой компонент женского молока значительно отличается от липидов коровьего молока. В первую очередь это связано с наличием в нем незаменимых ПНЖК, чрезвычайно важных для правильного роста и развития ребенка, формирования центральной нервной системы, адекватного иммунного ответа. Для адаптации жирового компонента «начальных» смесей в их состав вводятся растительные масла, богатые полиненасыщенными жирными кислотами. Соотношение линолевой и a-линоленовой жирных кислот в смесях последнего поколения приближается к таковому в женском молоке, составляя 8:1. Для улучшения усвоения жира в молочную смесь вводят небольшое количество природных эмульгаторов (лецитина, моно- и диглицеридов), которые способствуют образованию мелких жировых глобул и более легкому усвоению жира. В состав большинства смесей добавлен L-карнитин, способствующий ассимиляции жирных кислот на клеточном уровне. Современной тенденцией является обогащения смесей длинноцепочечными полиненасыщенными жирными кислотами (арахидоновой и докозагексаеновой), которые являются предшественниками эйкозаноидов (простагландинов, тромбоксанов, лейкотриенов), необходимых для миелинизации нервных волокон, дифференцировки клеток сетчатки глаза, участвующих в формировании и стабилизации клеточных мембран и др.
В качестве углеводного компонента используется, в основном, лактоза или ее комбинация с мальтодекстрином (до 25%), обладающим бифидогенным действием и снижающим осмолярность продукта. Ряд смесей содержит галакто- и фруктоолигосахариды, обладающие пребиотическими свойствами и способствующие избирательному росту в кишечнике индигенной флоры, преимущественно бифидобактерий. Некоторые продукты содержат лактулозу, также являющуюся пребиотиком.
Во все смеси включен необходимый набор витаминов и минеральных веществ в соответствии с физиологическими потребностями детей первых месяцев жизни, обеспечивающих оптимальное формирование и функционирование различных органов и систем ребенка. Это в первую очередь железо, медь, цинк, йод. В ряд смесей введен селен, обладающий выраженными антиоксидантными свойствами.
Соотношение кальция и фосфора в смесях находится в диапазоне 1,5:1–2,0:1, что обеспечивает правильное развитие костной ткани и предупреждает появление рахита. Оптимальное соотношение калия и натрия, равное 3:1. Для улучшения усвоения железа и его использования в процессах кроветворения очень важно наличие в продукте достаточного количества аскорбиновой кислоты (5–10 мг в 100 мл), а также оптимальное соотношение железа и цинка — 2:1 и железа и меди — 20:1, поскольку при таком балансе всасывание этих микроэлементов оптимально.
Уровень витаминов в адаптированных молочных смесях превышает таковой в женском молоке в среднем на 15–20%, так как их усвояемость более низкая, чем из женского молока. При этом большое внимание уделяется достаточному введению витамина D, участвующего в процессах обмена кальция и минерализации костной ткани. Его содержание в 100 мл готовой смеси составляет 40–50 МЕ. Во все смеси добавлены витамины группы В, витамин Е, обладающий антиоксидантной активностью, витамин А, принимающий участие в иммунных реакциях организма, а в некоторые смеси введен b-каротин.
Содержание белка, жиров, углеводов, минеральных веществ и витаминов в смесях должно соответствовать отечественным (Федеральный закон ФЗ-88 «Технический регламент на молоко и молочную продукцию» и «Гигиенические требования безопасности и пищевой ценности пищевых продуктов», СанПиН 2.3.2.1078-01, п. 3.1.1.1.) и международным (Codex Alimentarius Commission of FAO/WHO; European Society of Paediatric Gastroenterology, Hepatology and Nutrition /ESPGHAN/, Директива ЕС 2006 г) стандартам для адаптированных молочных смесей.
Важным показателем адекватности смеси физиологическим особенностям детей первого года жизни является ее осмоляльность (сумма растворимых компонентов, определяющих ее осмотическое давление). Избыточная осмоляльность смеси может создать дополнительную нагрузку на энтероциты слизистой оболочки тонкой кишки и незрелые почки ребенка и поэтому не должна превышать 290–320 мОсм/л.
«Последующие» смеси, в отличие от «начальных», содержат более высокое количество белка (до 2,1 г в 100 мл). Преобладание сывороточных белков над казеином уже не является обязательным, но при составлении композиции белкового компонента все большее число производителей отдают предпочтение преимущественному содержанию сывороточной фракции. Продукты для детей этой возрастной группы содержат весь необходимый набор витаминов и минеральных веществ в соответствии с рекомендуемыми нормами потребления и отличаются более высоким содержанием железа, кальция, цинка по сравнению с «начальными» смесями. Поскольку у детей к 4 — 5 месяцам жизни,полученные внутриутробно запасы железа истощаются, требуется дополнительное введение в смесь этого важного микронутриента.
Смеси «от 0 до 12 месяцев» могут использоваться в питании детей на протяжении всего первого года жизни. Однако эта группа продуктов немногочисленна и в современных условиях применяется ограничено, в связи с широким ассортиментом начальных и последующих формул.
В ряд сухих пресных смесей введены пробиотики: бифидо- и лактобактерии, являющиеся основной физиологической флорой кишечника ребенка («Агуша- GOLD 1» «Агуша- GOLD 2», «Нутрилак Бифи», «НАН 1», «НАН 2», «НАН Гипоаллергенный 1», «НАН Гипоаллергенный 2» и «ХиПП 2»). Современные технологии позволяют обеспечивать сохранность микроорганизмов в продукте на протяжении всего срока годности.
Кроме сухих адаптированных молочных смесей, существуют аналогичные им по составу жидкие продукты, как пресные, так и кисломолочные. Их использование имеет несомненные преимущества: они готовы к употреблению, исключается неправильная дозировка порошка, гарантировано качество используемой воды. Однако их производство налажено только в Европейской части России, поэтому целесообразно наладить выпуск таких продуктов на Урале, в Сибири и на Дальнем Востоке.
В настоящее время в питании грудных детей широко и успешно используются адаптированные кисломолочные продукты «Нутрилак кисломолочный» и «НАН кисломолочный» 1 и 2. Для их приготовления подбирают специальные штаммы лактобактерий: bulgaricus, helvetics, acidopfillus, а также Str. termophylus. Закваски могут быть монокомпонентными и комбинированными. В процессе молочнокислого брожения продукты приобретают ряд важных свойств: в них снижается уровень лактозы, накапливаются бактерицидные вещества, молочная кислота, происходит частичное расщепление молочного белка, что облегчает переваривание продукта и его усвоение, а также несколько снижает антигенность белкового компонента. После сквашивания в продукты вводят пробиотические штаммы B.lactis (BВ 12).
Адаптированные кисломолочные смеси могут вводиться в питание детей наряду с пресными молочными формулами с первых недель жизни. При этом возможно комбинировать их в соотношении 2:1 — 1:1, особенно при нарушениях процессов пищеварения и риске развития алиментарно-зависимых заболеваний. Применение только кисломолочных смесей может вызвать срыгивания, отказ ребенка от продукта.
Кефир и другие неадаптированные кисломолочные продукты недопустимо вводить в питание детей первого полугодия. В настоящее время рекомендовано их использование, начиная с 8 месяцев.
Алгоритм выбора адаптированной молочной смеси
При гипо- и агалактии у матери выбор наиболее адекватной для вскармливания ребенка смеси зависит от:
-
возраст ребенка (чем моложе ребенок, тем в большей степени он нуждается в смесях, максимально приближенных по составу к грудному молоку) - детям первых 6 месяцев жизни назначают «начальные» или «стартовые» смеси; с 6 мес. — «последующие» формулы;
-
социально-экономические условия семьи. Все дети грудного возраста нуждаются в современных адаптированных молочных продуктах. Дети из социально незащищенных семей должны получать питание бесплатно (адресная поддержка);
-
аллергоанамнез. При отягощенной наследственности первым продуктом выбора должна быть гипоаллергенная смесь;
-
индивидуальную переносимость продукта.
Критерием правильного выбора смеси является хорошая толерантность ребенка к данному продукту: ребенок с удовольствием ест смесь, у него отсутствуют диспепсические расстройства (срыгивания, рвота, жидкий, плохопереваренный стул или запоры), проявления атопического дерматита, дефицитные состояния (железодефицитная анемия, гипотрофия). Необходимо контролировать прибавку массы тела.
5. ОРГАНИЗАЦИЯ ПРИКОРМА [6]
Под прикормом подразумеваются все продукты, кроме женского молока и детских молочных смесей, дополняющие рацион пищевыми веществами, необходимыми дляобеспечения дальнейшего роста и развития ребенка.
Расширение рациона питания ребенка вызвано необходимостью дополнительного введения пищевых веществ, поступление которых только с женским молоком или детской молочной смесью становится недостаточным. Ребенок начинает испытывать потребность в широком комплексе минеральных веществ (железо, цинк, кальций и др.) и витаминов, других нутриентах (белке, углеводах, пищевых волокнах и др.), а также поступлении дополнительного количества энергии, необходимых для его дальнейшего роста и развития. Кроме того, своевременное введение прикорма способствует формированию жевательного аппарата и адекватных вкусовых привычек.
В последнее время в нашей стране активно дискутируются вопросы, связанные со сроками введения прикорма, особенно при естественном вскармливании. Согласно Резолюции Всемирной Ассамблеи Здравоохранения № 54.2 от 18 мая 2002 г. и № 59.13 от 4 мая 2006 г. детям, находящимся на исключительно грудном вскармливании, рекомендуется продолжать его до 6-ти месяцев и, следовательно, вводить прикорм с этого возраста. Отечественные ученые считают, что это возможно только в отношении здоровых детей, родившихся с нормальной массой тела (без гипотрофии или задержки внутриутробного развития) при полноценном питании матери с использованием специализированных обогащенных продуктов или комплексных витаминно-минеральных препаратов. В этом случае первым видом прикорма должны быть не традиционно используемые в России в настоящее время фруктовые соки и пюре, а продукты с высокой энергетической плотностью — каши промышленного производства, обогащенные всеми необходимыми ребенку в этом возрасте минеральными веществами и витаминами.
До настоящего времени в Российской Федерации действует схема введения прикорма, утвержденная Минздравом РФ в 1999 г., приведенная в Методических указания №225 «Современные принципы и методы вскармливания детей первого года жизни». Проведенные научные исследования и накопившийся опыт позволяют предложить внесение некоторых корректив и дополнений в указанную схему.
Установлено, что минимальный возраст, при котором возможно введение первых продуктов прикорма — 4 месяца. Ранее этого срока ребенок еще не готов к усвоению иной пищи, чем женское молоко или детская молочная смесь. К 4-х мес. возрасту гастроинтестинальный тракт ребенка становится более зрелым: снижается изначально повышенная проницаемость слизистой оболочки тонкой кишки, созревает ряд пищеварительных ферментов, формируется достаточный уровень местного иммунитета, ребенок приобретает способность проглатывать полужидкую и более густую пищу, связанную с угасанием «рефлекса выталкивания ложки».
В то же время поздний прикорм (после 6 мес.) может вызвать выраженный дефицит микронутриентов (железа, цинка и др.) и необходимость быстрого введения большого ряда продуктов, что приводит к повышенной антигенной нагрузке, а также к задержке формирования навыков жевания и глотания густой пищи.
Поэтому введение прикорма детям целесообразно проводить в возрасте 4–6 месяцев. Сроки введения прикорма устанавливаются индивидуально для каждого ребенка, c учетом особенностей развития пищеварительной системы, органов выделения, уровня обмена веществ, а также степенью развития и особенностями функционирования центральной нервной системы, то есть, его готовности к восприятию новой пищи. Учитывая, что современные адаптированные молочные смеси содержат в своем составе необходимый набор витаминов и минеральных веществ, нет необходимости проводить коррекцию по этим веществам продуктами прикорма в более ранние сроки, чем при вскармливании грудным молоком. Поэтому схема введения прикорма может быть единой. Предлагаемая примерная схема введения прикорма детям первого года жизни представлена в табл. 14.
Наименование продуктов и блюд (г, мл) |
Возраст (мес.) |
|||
4-6 |
7 |
8 |
9-12 |
|
Овощное пюре |
10—150 |
170 |
180 |
200 |
Молочная каша |
10—150 |
150 |
180 |
00 |
Фруктовое пюре |
5—60 |
70 |
80 |
90–100 |
Фруктовый сок |
5—60 |
70 |
80 |
90–100 |
Творог* |
10—40 |
40 |
40 |
50 |
Желток, шт. |
— |
0,25 |
0,5 |
0,5 |
Мясное пюре* |
5–30 |
30 |
50 |
60–70 |
Рыбное пюре |
— |
— |
5–30 |
30–60 |
Кефир и др. неадаптированные кисломолочные напитки |
— |
— |
200 |
200 |
Сухари, печенье |
— |
3–5 |
5 |
10–15 |
Хлеб пшеничный |
— |
— |
5 |
10 |
Растительное масло |
1–3 |
5 |
5 |
6 |
Сливочное масло |
1–4 |
4 |
5 |
6 |
*---не ранее 6 мес.
Последовательность введения отдельных продуктов и блюд прикорма зависит от состояния здоровья, нутритивного статуса ребенка и функционального состояния его пищеварительной системы. Так, детям со сниженной массой тела, учащенным стулом в качестве первого основного прикорма целесообразно назначать каши промышленного производства, обогащенные железом, кальцием, цинком, йодом, при паратрофии и запорах — овощное пюре.
В питании ребёнка целесообразно использовать продукты и блюда прикорма, промышленного производства, которые изготавливают из высококачественного сырья, соответствуют строгим гигиеническим требованиям к показателям безопасности, имеют гарантированный химический состав, в том числе витаминный, независимо от сезона, необходимую степень измельчения.
Характеристика продуктов прикорма
Зерновой прикорм (каша) — один из основных источников углеводов, растительных белков и жиров, пищевых волокон, железа, селена, витаминов В1, В2, РР и др. Прикорм на основе злаков следует начинать с безглютеновых круп (рисовой, гречневой, позднее кукурузной). Каши могут быть молочными или безмолочными. Последние разводят грудным молоком, детской смесью, получаемой ребёнком или коровьем молоком. В дальнейшем могут использоваться глютенсодержащие каши (овсяная, ячневая, пшеничная, манная) и каши из смеси круп.
Овощное пюре — источник органических кислот, калия, железа и пищевых волокон, включая пектины. Отдельные виды овощей (морковь, тыква, шпинат и др.) богаты b-каротином, предшественником витамина А. Вначале овощное пюре должно состоять из одного вида овощей, обладающих нежной клетчаткой, например, кабачков. Далее целесообразно использовать комбинацию из 3–4 овощей.
Цельное коровье молоко может использоваться в питании детей первого года жизни старше 4 мес. для приготовления молочных каш (не более 100–200 мл при отсутствии готовых молочных каш промышленного выпуска).
Творог и яичный желток — ценные источники животного белка и жира, минеральных веществ (кальция), а также витамина В2.
Мясо содержит полноценный животный белок, количество которого в говядине, нежирной свинине, мясе кролика, кур, цыплят, индейки, конины доходит до 20–21%. Мясо содержит хорошо усвояемое гемовое железо, магний, цинк, а также витамины В1, В2, В6 В12. Мясное пюре в рацион рекомендуется вводить детям старше 6 мес.
Рыба — полноценный источник белка и жира, содержащего большое количество полиненасыщенных жирных кислот в том числе класса w-3, а также витаминов В2, В12, минеральных веществ. Рыбу вводят в питание детей с 8–9 мес. с осторожностью, учитывая индивидуальную переносимость. Её используют 1–2 раза в неделю вместо мясного блюда.
Соки содержат природные сахара (глюкозу, фруктозу, сахарозу), органические кислоты (яблочную, лимонную и др.), положительно влияющие на процессы пищеварения. Они богаты калием (до 150 мг/100 мл и содержат железо (до 2 мг/100 мл). В соки промышленного производства могут быть добавлены витамин С, лимонная кислота, отдельные минеральные вещества, натуральные фруктовые ароматизаторы. Первым рекомендуют назначать яблочный или грушевый соки, которые традиционны для россиян и реже вызывают аллергические реакции.
Фруктовые пюре сходны по составу и пищевой ценности с фруктовыми соками, особенно с мякотью. В тоже время они содержат сахара, органические кислоты и пищевые волокна в большем количестве, чем соки.
Кисломолочные продукты детского питания (детский кефир, бификефир, йогурты «Агуша», «Тёма» и др.) в рацион ребёнка можно вводить не ранее 8-месячного возраста в количестве не более 200 мл в сутки.
Вода входит в состав всех пищевых продуктов, большое количество воды (около 85%) содержится в грудном молоке и детских молочных смесях. С «твёрдой» пищей (хлеб, каша, пюре и др.) ребёнок получает 30% воды. В настоящее время, как для питья, так и для приготовления смесей и блюд прикорма следует использовать специальную бутилированную воду для детского питания, поскольку она безопасна в бактериологическом отношении, не содержит вредных химических и радиоактивных веществ, обладает хорошими органолептическими свойствами, не требует кипячения, имеет низкую минерализацию.
Детские травяные чаи промышленного производства представляют собой сухие порошки и гранулы, содержащие экстракты лекарственных трав, растений, плодов (ромашка, укроп, фенхель, мелисса, мята, анис, черника, шиповник, брусника, малина и др.). В некоторые травяные чаи для улучшения вкусовых качеств введены фруктовые или ягодные добавки (смородина, малина, апельсин, шиповник, яблоки и др.). В состав травяных чаёв могут входить сахар, глюкоза, фруктоза, декстринмальтоза, витамины. Гранулированные чаи на основе сахаров (сахарозы, глюкозы и др.) назначаются детям не ранее 4 мес. жизни, а далее дифференцировано, в зависимости от индивидуальной переносимости.
При назначении прикорма следует придерживаться следующих правил:
-
введение каждого нового продукта начинают с небольшого количества, постепенно (за 5–7 дней) увеличивают до необходимого объёма; при этом внимательно наблюдают за переносимостью;
-
новый продукт (блюдо) следует давать в первой половине дня для того, чтобы отметить возможную реакцию на его введение;
-
каши, фруктовые и овощные соки и пюре начинают вводить с монокомпонентных продуктов, постепенно вводя другие продукты данной группы;
-
прикорм дают с ложечки, до кормления грудью или детской молочной смесью;
-
новые продукты не вводят, если ребёнок болен и в период проведения профилактических прививок.
Представляет большой интерес современная точка зрения на формирование вкусовых привычек. Доказано, что пренатальный и ранний постнатальный вкусовой и обонятельный опыт влияют на пищевые привычки в детском и взрослом возрасте. Поэтому беременным женщинам и кормящим матерям следует рекомендовать употреблять те продукты, которые она хотела бы предложить своему ребенку позже.
Принципиально важным моментом для матери является тот факт, что следует настойчиво предлагать ребенку сначала пробовать, а лишь затем съедать новые продукты разнообразного вкуса и состава. Мать должна предлагать новую пищу, показывать новые продукты, принимать пищу в присутствии ребенка, повторять предложение в случаях первоначального отказа. Установлено, что для «принятия» нового вкуса может потребоваться до 8–10 попыток введения нового блюда, а в отдельных случаях 12–15 «встреч».
Для сохранения лактации, в период введения продуктов и блюд прикорма необходимо после каждого кормления прикладывать ребенка к груди.
6. ПИТАНИЕ ПРИ ЖЕЛЕЗОДЕФИЦИТНЫХ АНЕМИЯХ (МКБ-10 D50) [7]
Железодефицитная анемия (ЖДА) — это патологическое состояние, обусловленное снижением содержания гемоглобина в результате дефицита железа в организме вследствие его недостаточного поступления, повышенных потерь или нарушенного всасывания.
Около двух миллиардов человек на планете имеют дефицит железа, причем половина случаев приходится на долю железодефицитной анемии. В детской популяции распространенность недостаточности железа может достигать 30–60% у детей раннего возраста и 17,5% — у школьников.
В зависимости от уровня гемоглобина выделяют три степени тяжести ЖДА (табл. 15).
| Степень тяжести | Уровень гемоглобина (г/л) |
|---|---|
Легкая |
<110 |
Средней тяжести |
<90 |
Тяжелая |
<70 |
Доказано, что длительный дефицит железа и ЖДА у детей раннего возраста приводит к замедлению моторного развития и нарушению координации, задержке речевого развития, психологическим и поведенческим нарушениям (невнимание, слабость, неуверенность в себе и т.д.), снижению физической активности.
Принципы терапии железодефицитных состояний
Целью терапии железодефицитных состояний (ЖДС) является устранение дефицита железа и восстановление его запасов в организме. Лечение должно проводиться в соответствии со следующими принципами: преимущественное использование препаратов железа для перорального приема, продолжение поддерживающего комплексного медикаментозного (при необходимости) и диетологического лечения после нормализации уровня гемоглобина, проведение гемотрансфузий строго по жизненным показаниям.
Медикаментозная терапия при железодефицитных состояниях всегда должна проводиться на фоне правильно организованного питания.
Лечебное питание при железодефицитных состояниях
Существующие нормы потребления железа (табл. 16) превышают физиологическую потребность организма с учетом биодоступности железа из обычного рациона, которая, в среднем, составляет 10%. Полноценная и сбалансированная по основным ингредиентам диета позволяет обеспечить физиологическую потребность организма в этом эссенциальном микроэлементе, но не устраняет дефицит железа.
Возраст |
Физиологические потребности (мг/сутки) |
Нормы потребления (мг/сутки) |
|
Россия |
США |
||
0–3 мес |
0,96 |
4,0 |
6,0 |
4–6 мес |
0,96 |
7,0 |
6,0 |
7 –12 мес |
0,96 |
10,0 |
10,0 |
1–2 года |
0,61 |
10,0 |
10,0 |
Беременные женщины |
1,31 |
33,0 |
30,0 |
Железо присутствует в продуктах питания в 2-х формах: гемовой и негемовой. Источниками гемового железа являются гемоглобин и миоглобин в составе продуктов животного происхождения (мясо животных и птицы). В продуктах растительного происхождения (овощи, фрукты, злаки), а также в молоке и рыбе железо содержится в негемовой форме (табл. 17, 18).
| Продукты | Суммарное содержание Fе (мг/100 г) | Основные железосодержащие соединения |
|---|---|---|
Печень |
6,9 |
Ферритин, гемосидерин |
Язык говяжий |
4,1 |
Гем |
Мясо кролика |
3,3 |
Гем |
Мясо индейки |
1,4 |
Гем |
Мясо курицы |
1,6 |
Гем |
Говядина |
2,7 |
Гем |
Конина |
3,1 |
Гем |
Скумбрия |
1,7 |
Ферритин, гемосидерин |
Сазан |
0,6 |
Ферритин, гемосидерин |
Судак |
0,5 |
Ферритин, гемосидерин |
Хек/треска |
0,5 |
Ферритин, гемосидерин |
| Продукты | Железо | Продукты | Железо |
|---|---|---|---|
Морская капуста |
16 |
Петрушка зелень |
1,9 |
Шиповник свежий |
1,3 |
Укроп |
1,6 |
Гречка ядрица |
6,7 |
Капуста цветная |
1,4 |
Геркулес |
3,6 |
Капуста брюссельская |
1,3 |
Толокно |
3,0 |
Свекла |
1,4 |
Пшено крупа |
2,7 |
Курага |
3,2 |
Кукуруза крупа |
2,7 |
Инжир свежий |
3,2 |
Орехи |
2,3–5,0 |
Чернослив |
3,0 |
Хлеб бородинский |
3,9 |
Хурма |
2,5 |
Хлеб формовой |
3,9 |
Груша свежая |
2,3 |
Хлеб рижский |
3,1 |
Яблоко свежее |
2,2 |
Батон нарезной мука высш. сорта мука 1 сорта |
1,2 2,0 |
Алыча |
1,9 |
Чечевица, зерно |
11,8 |
Облепиха |
1,4 |
Соя, зерно |
9,7 |
Смородина черная |
1,3 |
Горох, зерно |
6,8 |
Земляника |
1,2 |
Шпинат |
3,5 |
Малина |
1,2 |
Щавель |
2,0 |
Гранаты |
1,0 |
Большая часть поступающего с пищей железа представлена его негемовой формой (90%). Основное количество железа (около 90%) всасывается в 12-перстной кишке, остальное — в самом верхнем отделе тощей кишки.
Биодоступность железа из злаковых, бобовых, клубневых, овощей и фруктов значительно ниже, чем из гемовых соединений и во многом зависит от преобладания в рационе факторов, либо ингибирующих, либо потенцирующих всасывание железа (табл. 19).
| Активаторы всасывания | Ингибиторы всасывания |
|---|---|
Аскорбиновая кислота |
Соевый протеин |
Мясо (белок) |
Фитаты |
Мясо птицы (белок) |
Кальций |
Рыба (белок) |
Пищевые волокна |
Молочная кислота |
Полифенолы, содержащиеся в бобах, орехах, чае, кофе и некоторых овощах |
| Продукты | Содержание железа, мг/100 г | Всасываемое железо, мкг/100 г | Всасывание железа, % |
|---|---|---|---|
Женское молоко |
0,04 |
0,02 |
20–50 |
Коровье молоко |
0,02 |
0,002 |
10 |
Детская молочная смесь |
0,7–0,9 |
0,12 |
20 |
Детская молочная смесь, обогащенная железом |
1,1–1,4 |
0,22–0,28 |
20 |
Каши, обогащенные железом |
1,6–1,9 |
0,33–0,34 |
20 |
Морковь |
0,5 |
0,02 |
4 |
Говядина |
1,2 |
0,46 (всего) |
23 (гемовое) |
1,8 |
8 (негемовое) |
В табл. 20 представлены данные о содержании и биодоступности гемового и негемового железа из разных продуктов, в т.ч. грудного молока.
Современные подходы к коррекции рационов питания детей строятся с учетом уровня гемоглобина, возраста и нутритивного статуса ребенка.
При латентном дефиците железа (нормальный уровень гемоглобина, снижение запасов железа в организме) у детей положительный эффект может быть достигнут за счет введения продуктов прикорма, богатых и обогащенных железом. Однако при железодефицитной анемии (Нb<110 г/л) ребенок нуждается в назначении препаратов железа в комплексе с диетотерапией, которая продолжается и после окончания медикаментозного лечения и способствует нормализации содержания железа в депо организма.
Профилактика железодефицитных состояний
Современные представления о механизмах развития железодефицитных состояний помогают выделить группу повышенного риска по развитию ЖДА и своевременно и эффективно проводить профилактические мероприятия.
Профилактика железодефицитной анемии у детей первых месяцев жизни включает рациональное питание женщины в период беременности и лактации с использованием достаточного количества мясных продуктов, фруктов и овощей, богатых витамином С, а также специализированных продуктов, содержащих минеральные вещества и витамины, необходимые для полноценного гемопоэза (табл. 9, 12). Назначение женщине пероральных ферропрепаратов или витаминно-минеральных комплексов показано при содержании гемоглобина ниже 110 г/л.
Естественной профилактикой ЖДА у детей первых месяцев жизни считается исключительно грудное вскармливание до 4–6 месяцев жизни. Концентрация железа в женском молоке составляет 0,2–0,4 мг/л и этого достаточно для обеспечения потребностей растущего организма ребенка в железе благодаря его высокой биодоступности (50%). Однако имеются данные о том, что анемия встречается у каждого третьего ребенка, находящегося на грудном вскармливании, при этом частота этой патологии достоверно не зависит от длительности грудного вскармливания. Вероятно, основная причина заключается в значительной распространенности сидеропенических состояний у кормящих женщин.
При искусственном вскармливании для детей первого полугодия жизни используют смеси с содержанием железа от 0,4 до 0,8 мг/100 мл, что является вполне достаточным, так как еще используются запасы железа, накопленные в течение внутриутробного периода. К 4–6 месячному возрасту ребенка они истощаются и метаболизм становится абсолютно зависимым от количества микронутриентов, поступающих с пищей. Поэтому содержание железа в «последующих» адаптированных молочных смесях (для детей второго полугодия жизни) возрастает до 0,9–1,3 мг/100 мл. Помимо этого в качестве прикорма целесообразно включение в питание продуктов промышленного производства, обогащенных железом (инстантные каши, фруктовые соки, фруктовые и овощные пюре), что повышает количество железа, поступающего с пищей в организм ребенка. Для восполнения дефицита железа необходимо учитывать не только суммарное количество железа в продуктах, но и качественную форму его соединений.
Несмотря на высокое содержание железа в некоторых продуктах растительного происхождения, они не в состоянии обеспечить высокие потребности растущего детского организма в железе. Присутствующие в таких продуктах вещества (танины, фитины, фосфаты) образуют с Fe (III) нерастворимые соединения, которые выводятся с калом. Имеются также сведения о неблагоприятном влиянии на абсорбцию железа пищевых волокон. Ими богаты крупы, свежие овощи, фрукты. В кишечнике пищевые волокна практически не перевариваются, железо фиксируется на их поверхности и выводится из организма. Напротив, повышают биодоступность железа аскорбиновая, лимонная и другие органические кислоты, а также животный белок (мясо, рыба).
Важно, что продукты из мяса и рыбы увеличивают всасывание железа из овощей и фруктов при одновременном их применении. Учитывая вышесказанное, а также высокое содержание в мясе легкодоступного железа мясной прикорм рекомендуется вводить не позднее 6 месяцев (детские мясные консервы «Агуша», «ФрутоНяня» и др.).
Цельное коровье молоко в питании детей до 8 мес. может использоваться только для приготовления каш (одна порция). Концентрация железа в коровьем молоке составляет всего 0,3 мг/л, а его биодоступность около 10%. Многочисленные исследования показали, что использование значительных количеств неадаптированных продуктов (коровьего молока и кефира) в питании детей грудного возраста (до 8 мес.) приводит к возникновению микродиапедезных желудочно-кишечных кровотечений, что является фактором риска развития ЖДС.
7. ПРОФИЛАКТИКА И ЛЕЧЕНИЕ РАХИТА (МКБ-10 Е55.0)
Рахит (D-дефицитный, классический) — многофакторное заболевание, которое характеризуется нарушениями фосфорно-кальциевого обмена и минерализации костной ткани. В настоящее время общепринятым является определение рахита как заболевания, обусловленного временным несоответствием между потребностями растущего организма в кальции и фосфоре и недостаточностью систем, обеспечивающих их доставку в организм ребенка. При данном заболевании патологический процесс локализуется главным образом в эпиметафизах костей, остеопатические проявления рахита наиболее выражены у детей первых 2–3 лет жизни.
Одним из основных патогенетических факторов рахита является недостаточное потребление с пищей витамина D, кальция, фосфора, а также других необходимых для образования гормональных форм витамина D минеральных элементов, особенно меди, цинка, витаминов группы В и аскорбиновой кислоты. Помимо алиментарного фактора нарушению развития костной ткани способствуют незрелость и гетерохрония развития (дисфункция) эндокринных желез, различные соматические заболевания, протекающие с мальдигестией и мальабсорбцией и т.д. Важными звеньями патогенеза рахита являются нарушения образования холекальциферола в коже и регуляции фосфорно-кальциевого обмена в печени, почках.
Серьезными проявлениями рахита является остеопения/ остеопороз, вегетативная дисфункция, приводящая к нарушению работы различных органов и систем организма, снижение общей иммунобиологической реактивности.
Клиническая манифестация рахита, как правило, встречается в весеннее и зимнее время года, особенно у детей, проживающих в регионах с недостаточной инсоляцией, частыми туманами, облачностью или в районах экологического неблагополучия.
Часто рахит развивается у детей, родившихся либо у юных матерей (моложе 17 лет), либо у женщин в возрасте старше 35 лет. Большое значение для формирования нарушений фосфорно-кальциевого обмена у ребенка имеет несбалансированное питание беременной женщины: дефицит кальция, цинка, белка, фосфора, витаминов D, В1, В2, В6. Рахит чаще развивается у детей, матери которых во время беременности недостаточно пребывали на солнце, мало двигались, имели экстрагенитальные заболевания.
Антенатальная профилактика рахита
Антенатальная профилактика рахита предусматривает соблюдение режима дня беременной с достаточным сном в дневное и ночное время, прогулки на свежем воздухе не менее 2–4 часов ежедневно, в любую погоду.
Помимо этого необходимо организовать рациональное питание беременной женщине (см. главу 1), обеспечивающее достаточное поступление кальция, фосфора, витамина D (табл. 21).
| Возраст | кальций (мг) | фосфор (мг) | витамин D (мкг)* |
|---|---|---|---|
0–3 мес. |
400 |
300 |
10 |
4–6 мес. |
500 |
400 |
10 |
7 –12 мес. |
600 |
500 |
10 |
1 — 2 года |
800 |
700 |
10 |
Беременные женщины |
1300 |
1000 |
12,5 |
Кормящие матери |
1400 |
1000 |
12,5 |
* --- эквиваленты: 1 МЕ — 0,025 мкг, 1 мкг — 40 МЕ витамина D3
Лучшим пищевым источником кальция являются молочные продукты (сыры, молоко, кефир, творог).
Вместо молока целесообразно применять специализированные молочные напитки, предназначенные для беременных женщин, способные предупредить нарушения фосфорно-кальциевого обмена у будущих матерей и у плодов. При их отсутствии можно рекомендовать курсовой прием витаминно-минеральных комплексов.
Всем беременным в зимне-весенний период в течение 8 недель (28–32 недель беременности) назначается витамин D в дозе 400 МЕ в сутки. Женщинам из группы риска (гестозы, сахарный диабет, гипертоническая болезнь, ревматизм и др.) витамин D назначается в дозе 400 МЕ в течение 8 недель с 28 по 32 беременности вне зависимости от времени года.
Постнатальная профилактика рахита
Для профилактики рахита чрезвычайно важным является правильно организованное питание ребенка. Наилучшим для детей первого года жизни является грудное вскармливание, при этом следует обратить внимание на питание кормящей женщины (см. главу 2).
При искусственном вскармливании необходимо использовать только адаптированные молочные смеси, их углеводный компонент представлен в основном лактозой, усиливающей всасывание кальция, колекальциферола. В женском молоке биодоступность и соотношение между кальцием и фосфором оптимальны. В детских молочных смесях допустимо соотношение 1,2–2,0:1.
Очень важно своевременно вводить в рацион плодовоягодные и овощные соки и пюре. При выборе продуктов следует обращать внимание на содержание в них витамина С, являющегося одним из наиболее активных регуляторов обменных процессов в организме. Рекомендуется использовать овощи с более высоким содержанием кальция и фосфора: морковь, капусту бело- и краснокочанную, репу, тыкву, кабачок, корень и зелень петрушки, шпинат, укроп. Необходимо своевременное введение в рацион творога и яичного желтка, который богат жирорастворимыми витаминами (в 10 г яичного желтка содержится от 20 до 50 МЕ витамин D), витаминами группы В, кальцием и микроэлементами. При использовании злакового прикорма предпочтение отдают гречневой, овсяной, а в дальнейшем и смешанным кашам промышленного производства, которые обогащены витаминно-минеральным комплексом, в том числе витамином D. При приготовлении каш в домашних условиях в конце варки рекомендуется добавлять в них ягоды, фрукты (сухофрукты) или овощи. Это позволяет не только обогатить каши витаминами и микроэлементами, но значительно улучшить их вкусовые качества. Целесообразно также введение в рацион детей адаптированных кисломолочных продуктов, благотворно влияющих на усвоение пищевых веществ, в том числе солей кальция.
Постнатальная специфическая профилактика рахита проводится у детей, находящихся как на искусственном, так и на естественном вскармливании. Для этого используется витамин D, профилактическая доза которого составляет для здоровых доношенных детей 400–500 МЕ в сутки. Специфическая профилактика рахита препаратами витамина D доношенным детям проводится в осенне-зимневесенний периоды на первом и втором году жизни.
Дети с малыми размерами родничка имеют лишь относительные противопоказания к профилактическому назначению витамина D. Специфическая профилактика рахита этим детям проводится, начиная с 3–4 месяцев жизни, под контролем размеров большого родничка и темпов роста окружности головы.
Клинические проявления рахита
Развитие рахита у детей раннего возраста начинается с синдрома вегето-висцеральных дисфункций, затем присоединяются костные изменения.
Клиническая симптоматика и лабораторные показатели в различные периоды рахита представлены в таблице 22.
| Степень тяжести | Клиническая симптоматика | Биохимические показатели | Данные R-графии |
|---|---|---|---|
I – легкая |
Признаки остеомаляции: «податливость» краев большого родничка и швов черепа (краниотабес) |
Кальций крови в норме, фосфор крови в норме или слегка снижен, ЩФ крови может быть незначительно повышена |
Обычно отсутствуют, но может определяться остеопения |
II – средне-тяжелая |
Признаки остеоидной гиперплазии: деформация черепа (лобные и теменные бугры), грудной клетки, (четки) конечностей (браслетки). Мышечная гипотония. Формирование варусной или вальгусной деформации нижних конечностей, когда дети начинают вставать. |
Умеренная гипокальциемия, выраженная гипофосфатемия, значительное повышение уровня ЩФ крови |
Расширение и неровность метафизарной щели, бокаловидные деформации эпиметафизарных отделов костей, нечеткость ядер окостенения. Остеопения или остеопороз, грубый трабекулярный рисунок диафизарных отделов. «Рахитический» метафиз. |
III – тяжелая |
Выраженные признаки остеоидной гиперплазии: тяжелые деформации скелета. Мышечная гипотония. Позднее становление статических функций. Полиорганная дисфункция. |
Выраженная гипокальциемия и гипофосфатемия, сохраняется значительное повышение активности ЩФ |
Рахитический метафиз, переломы по типу зеленой веточки, остеопороз |
Течение рахита может быть острым, подострым и рецидивирующим.
Острое течение отмечается у быстрорастущих детей первого полугодия жизни и характеризуется преобладанием остеомаляции над процессами остеоидной гиперплазии, интенсивным нарастанием симптомов. Подострое течение чаще наблюдается у детей с внутриутробной или постнатальной гипотрофией, у недоношенных детей или младенцев, получивших недостаточную дозу витамина D; отличается более медленным развитием симптомов болезни и преобладанием процессов остеоидной гиперплазии над остеомаляцией. Рецидивирующее течение характеризуется чередованием клинического улучшения и обострения процесса на фоне различных соматических заболеваний, нарушения вскармливания младенцев, дефектов ухода и др. Отсутствие противорецидивной терапии приводит к непрерывному прогрессированию рахита.
Лечение рахита
Лечебные мероприятия при рахите направлены на восстановление фосфорно-кальциевого гомеостаза, устранение дефицита витамина D, нормализацию процессов перекисного окисления липидов, ликвидацию метаболического ацидоза.
Для эффективного лечения рахита назначается комплекс мероприятий по нормализации режима жизни ребенка, с достаточной инсоляцией, обеспечение его полноценным сбалансированным питанием. Одновременно с препаратами кальция и фосфора назначается терапия витамином D, что способствует оптимизации фосфорнокальциевого обмена.
Наиболее целесообразно для лечения рахита использовать водный раствор витамина D3 (в одной капле 500 МЕ) или масляные растворы витамина D3 (в одной капле 500 МЕ) и витамина D2 (в одной капле 625–1250 МЕ) — (табл. 23).
| Препарат | Действующее вещество | Форма выпуска и дозировка |
|---|---|---|
Водный раствор витамина D3 |
Холекальциферол |
Водный раствор, 1 капля — 500 МЕ |
Масляный раствор витамина D3 |
Холекальциферол |
Масляный раствор, 1 капля — 500 МЕ |
Масляный раствор витамина D2 |
Эргокальциферол |
Масляный раствор 0,0625% (1 капля — 625 МЕ) 0,125% (1 капля — 1250 МЕ) |
В настоящее время спиртовый раствор витамина D2 применяется редко ввиду его высокой концентрации и возможности передозировки.
В соответствии с действующими Методическими рекомендациями МЗ СССР, 1990 г. «Профилактика и лечение рахита у детей раннего возраста» лечебная доза витамина D составляет 2000–5000 МЕ в сутки (таблица 24). При подборе индивидуальной дозы витамина D учитываются особенности клинической картины рахита, степень его тяжести и динамика заболевания.
| Доза витамина D | Суточная доза витамина D | Продолжительность курса |
|---|---|---|
Лечебная |
2000–5000 МЕ |
30–45 дней |
Поддерживающая |
400–500 МЕ |
до 2 летнего возраста и в зимний период на третьем году жизни |
Противорецидивный курс |
2000–5000 МЕ |
3–4 недели (1–2 курса) |
Профессор Мальцев С.В. (1997) предлагает схему лечения рахита в зависимости от степени тяжести заболевания: суточная доза витамина D при I-ой степени — 1000–1500 МЕ в течение 30 дней, при II-ой степени — 2000–2500 МЕ в течение 30 дней, при III-й степени — 3000–4000 МЕ в течение 45 дней.
Для уточнения доз витамина D при лечении рахита необходимо проведение дополнительных исследований по выявлению гиповитаминоза D. Основным надежным критерием обеспеченности детского организма витамином D является уровень 25(ОН) D3 в крови. В норме у здоровых детей он составляет от 15 до 40 нг/мл, повышаясь летом благодаря инсоляции до 25–40 нг/мл и снижаясь ранней весной до 15–25 нг/мл. Cнижение уровня 25(ОН) D3 до 10 нг/мл свидетельствует о D-дефиците, а содержание ниже 5 нг/мл соответствует состоянию D-авитаминоза.
Положительный терапевтический эффект достигается только при комплексном подходе: оптимизации вскармливания ребенка, сбалансированном поступлении солей кальция, фосфора и витамин D-терапии, а также использовании естественных общеоздоровительных мероприятий (массаж, лечебная гимнастика, прогулки, водные процедуры).
8. ПИТАНИЕ ПРИ ГИПОТРОФИИ (МКБ-10 Е44–46) [9]
Гипотрофия (один из видов нарушения нутритивного статуса) — хроническое расстройство питания, характеризующееся дефицитом массы тела по отношению к росту и возрасту. Это состояние преимущественно наблюдается у детей раннего возраста в связи с высокими темпами роста и активностью обменных процессов, требующих достаточного поступления пищевых веществ.
Выделяют 3 основные группы причин, приводящих к развитию гипотрофии у детей:
-
недостаточное поступление пищевых веществ (дефицитное питание или затруднения при приеме пищи);
-
нарушение переваривания и усвоения пищи (синдром мальабсорбции);
-
неадекватное обеспечение повышенных потребностей в нутриентах (недоношенные дети, врожденные пороки сердца, хроническая патология легких, тяжелые инфекции, сопровождающихся катаболическим стрессом и др.).
Гипотрофия может развиться под влиянием как экзогенных, так и эндогенных факторов (табл. 25).
| Эндогенные факторы | Экзогенные факторы |
|---|---|
– Врожденные пороки развития (сердечно-сосудистой и бронхо-легочной систем, желудочно-кишечного тракта, печени, мочевыделительной системы) – Врожденные или приобретенные поражения ЦНС (церебральная ишемия, внутричерепные кровоизлияния и др.) – Синдром мальабсорбции (целиакия, муковисцидоз, синдром короткой кишки и др.) – Врожденные иммунодефицитные состояния – Некоторые эндокринные заболевания и др. (пангипопитуитаризм, б-нь Аддисона, нарушения функции щитовидной железы и др.) – Наследственные нарушения обмена веществ – Длительная интоксикация при хронических инфекционных болезнях (туберкулез, бруцеллез и др.) и гнойных процессах (абсцессы, нагноившиеся бронхоэктазы, остеомиелит) – Тяжелые острые инфекционные заболевания, сопровождающиеся интоксикацией, рвотой, частым стулом – Тяжелые неинфекционные заболевания (злокачественные опухоли тяжелая сердечная, дыхательная недостаточность и др.) – Тяжелая термическая и сочетанная травма. |
– Алиментарные (количественный и качественный недокорм при естественном и искусственном вскармливании, неправильное введение прикорма, дефекты ухода) |
В настоящее время в нашей стране у детей значительно чаще встречается не алиментарная недостаточность питания, а гипотрофия, обусловленная тяжелыми врожденными или приобретенными патологическими состояниями, приводящими к повышению потребностей в пищевых веществах или нарушению усвоения нутриентов. Такое расстройство нутритивного статуса в западно-европейской терминологии обозначается как undernutrition.
На наш взгляд, нельзя полностью отождествлять понятия гипотрофия и белково-энергетическая недостаточность (БЭН). Термин БЭН был предложен в 1961 г. Объединенным комитетом экспертов ФАО/ВОЗ по вопросам питания для обозначения таких тяжелых алиментарно-зависимых дефицитных заболеваний, как квашиоркор или маразм, а также переходных к ним состояний. БЭН развивается в результате длительного и выраженного преимущественно белкового (квашиоркор) и/или белковоэнергетического (маразм) голодания и проявляется дефицитом массы тела и/или роста, комплексным нарушением гомеостаза в виде изменения основных метаболических процессов, водно-электролитного дисбаланса, нарушениями нервной регуляции, эндокринным дисбалансом, угнетением иммунной системы, дисфункциями желудочно-кишечного тракта и других органов и систем.
Патогенез гипотрофии определяется вызвавшим ее заболеванием, но во всех случаях он включает постепенно углубляющиеся нарушения обмена веществ с истощением запасов жиров и углеводов, усилением катаболизма белка и снижением его синтеза. Возникает дефицит многих эссенциальных микроэлементов, ответственных за реализацию иммунных функций, оптимальный рост, развитие мозга. Поэтому длительно текущей гипотрофии часто сопутствует отставание в психомоторном развитии, задержка речевых и когнитивных навыков и функций, высокая инфекционная заболеваемость вследствие снижения иммунитета, что в свою очередь усугубляет расстройство питания.
До настоящего времени в нашей стране отсутствует общепризнанная и утвержденная на Съезде педиатров классификация гипотрофий у детей.
Отечественные педиатры преимущественно дифференцируют гипотрофию по времени возникновения и по дефициту массы тела (табл. 26).
| Форма | Степень гипотрофии в зависимости от дефицита массы тела (%) |
|---|---|
Пренатальная (внутриутробная) Постнатальная (приобретенная) |
I степень 10–20% II степень 20–30% III степень 30% и более |
Различают пренатальную (врожденную) и постнатальную (развившуюся после рождения) гипотрофию. В основе пренатальных гипотрофий лежат нарушения внутриутробного развития плода вследствие недостаточности плацентарного кровообращения, воздействия инфекционных, наследственных и конституциональных особенностей матери, а также неблагоприятных социально-экономических, производственных и экологических факторов.
Зарубежные авторы пользуются классификацией, предложенной Waterlow. В ее последней модификации (табл. 27) выделяют 2 основные формы БЭН: острую, проявляющуюся преимущественной потерей массы тела и ее дефицитом по отношению к долженствующей массе тела по росту, и хроническую, проявляющуюся не только дефицитом массы тела, но и существенной задержкой роста. Обе формы имеют 3 степени тяжести: легкую, средне-тяжелую и тяжелую.
Степень/Форма |
Острая БЭН |
Хроническая БЭН |
% от долженствующей массы по росту |
% от долженствующего роста по возрасту |
|
0 (норма) |
> 90 |
> 95 |
I (легкая) |
81–90 |
90–95 |
II (средне-тяжелая) |
70–80 |
85–89 |
III (тяжелая) |
< 70 |
< 85 |
Диагностика
Для выявления нарушения питания у детей используют клинические и лабораторные методы (табл. 28).
| Клинические | Лабораторные |
|---|---|
– Анамнестические данные – Клинический осмотр с учетом специфических симптомов гипотрофии и гиповитаминоза – Антропометрия с расчетом Z-score – Измерение толщины кожно-жировых складок |
– Содержание сывороточного альбумина и короткоживущих белков – Оценка иммунного статуса |
Соматометрические методы являются ключевым способом оценки нутритивного статуса ребенка. Необходимым элементом антропометрии является наличие таблиц сравнения массо-ростовых и возрастных показателей и/или карты центильного распределения показателей веса и роста. В 2006 году Всемирная Организация Здравоохранения предложила «Стандартные Карты Роста» детей всех возрастных групп для использования в широкой педиатрической практике. Эти карты содержат распределение детей по массо-возрастным, росто-возрастным, массо-ростовым показателям, а также по величине индекса массы тела.
Поскольку наиболее объективными показателями состояния физического развития ребенка является не только масса тела, но и рост, целесообразно пользоваться центильными таблицами. Сочетанный дефицит массы тела и роста развивается не только при длительно текущем недостаточном питании, но и при тяжелых хронических заболеваниях ребенка.
В эпидемиологических исследованиях распространенности гипотрофии у детей используют показатель Z-скор, который представляет собой отклонение значений индивидуального показателя (масса тела, рост) от среднего значения для данной популяции, деленное на стандартное отклонение среднего значения.
В стандартной популяции средняя величина Z-скор равна нулю при величине стандартного отклонения, равной 1,0. Положительные величины Z-скор свидетельствуют об увеличении антропометрического показателя по сравнению со стандартом, а отрицательные — о его снижении. Ориентируясь на данные показатели, можно оценить тяжесть БЭН или гипотрофии (табл. 29).
Степень/Форма |
Острая БЭН |
Хроническая БЭН |
% от долженствующей массы по росту и Z-скор |
% от долженствующего роста по возрасту и Z-скор |
|
0 (норма) |
90–110 +Z — -Z |
95 — 105 +Z — -Z |
I (легкая) |
80 — 89 -1,1 Z — -2 Z |
90 — 94 -1,1 Z — -2 Z |
II (средне-тяжелая) |
70 — 79 -2,1 Z — -3 Z |
85 — 89 -2,1 Z — -3 Z |
III (тяжелая) |
< 70 < -3 Z |
< 89 < -3 Z |
По выраженным отрицательным значениям показателя Z-скор можно судить об отставании в физическом развитии. Например, ребенок 3-х месяцев имеет массу тела 4 кг, тогда как средняя масса тела для детей этого возраста — 6 кг.
В соответствии с формулой его Z-скор равен –2, что говорит о значительном отставании в физическом развитии.
Биохимические методы оценки гипотрофии включают определение содержания альбумина и короткоживущих белков (транстиретин, ретинолсвязывающий белок, трансферрин).
Иммунные маркеры гипотрофии — это абсолютная лимфопения, снижение соотношения CD4/CD8, задержка тестов гиперчувствительности (показатели клеточного иммунитета), а также снижение уровня иммуноглобулинов, характеризующих состояние гуморального иммунитета. Эти показатели не полностью отражают тяжесть гипотрофии и степень восстановления нутритивного статуса, но имеют важное прогностическое значение.
Диетическая коррекция гипотрофии
Основные подходы к ведению больных с гипотрофией:
-
устранение факторов, обусловливающих нарушение нутритивного статуса;
-
лечение основного заболевания;
-
адекватная диетотерапия включает в себя:
-
учет возраста, остроты, тяжести и характера основного заболевания;
-
обеспечение возрастных потребностей ребенка в энергии, макро- и микронутриентах путем постепенного увеличения пищевой нагрузки с учетом толерантности ребенка к пище, а при гипотрофии II–III степени в дальнейшем высококалорийная/высокобелковая диета;
-
систематический учет фактического питания с расчетом химического состава суточного рациона по основным пищевым нутриентам и энергии;
-
при гипотрофии II–III степени — «омоложение» диеты (увеличение частоты кормлений с преимущественным использованием женского молока или специализированных легкоусвояемых продуктов), в наиболее тяжелых случаях применение постоянного зондового питания в сочетании с частичным парентеральным питанием;
-
следует избегать необоснованного вытеснения женского молока или детских молочных смесей продуктами прикорма;
-
последовательное и постепенное введение продуктов прикорма с учетом нутритивного статуса ребенка (в качестве первого прикорма целесообразно введение каш);
-
использование продуктов прикорма промышленного производства;
-
-
организация адекватного режима, ухода, массажа;
-
стимуляция сниженных защитных сил организма или заместительная иммунотерапия (по показаниям);
-
лечение сопутствующих заболеваний и осложнений.
Гипотрофия I степени развивается под влиянием недостаточного питания или различных соматических и инфекционных заболеваний. В первом случае необходимо наладить общий режим, уход за ребенком, устранить дефекты вскармливания. Предпочтение при назначении питания следует отдавать грудному молоку, а при смешанном и искусственном вскармливании — адаптированным молочным смесям, обогащенным про- и пребиотиками, благоприятно влияющими на процессы пищеварения и нормализацию состава микрофлоры кишечника; нуклеотидами, которые улучшают всасывание пищевых веществ и стимулируют иммунную систему ребенка, а также кисломолочным смесям в количестве не более 1/2 от общего объема кормления. Неадаптированные кисломолочные продукты (кефир, йогурт и т.п.) не должны назначаться детям ранее 8–9 месячного возраста. Для повышения энергетической ценности рациона и увеличения квоты белка необходимо своевременное введение прикорма (каши, овощное пюре с мясом и растительным маслом, творог).
При гипотрофии, развившейся на фоне соматической или инфекционной патологии основной продукт питания (грудное молоко и лечебная смесь) назначается с учетом основного заболевания.
При гипотрофии I степени расчеты и коррекция питания проводятся на долженствующую массу тела, которая складывается из массы тела при рождении и суммы нормальных ее прибавок за прожитый период (табл. 30). Однако ряд заболеваний требует повышение энергетической ценности рациона (бронхо-легочная дисплазия, целиакия, муковисцидоз и др., см. соответствующие разделы).
Период |
Длительность периода |
Число кормлений (n) |
Калорийностьккал/кг/день |
Белки г/кг/день |
Углеводы г/кг/день |
Жиры г/кг/день |
гипотрофия I степени |
||||||
Репарационный |
7–10 дней и более |
по возрасту n = 5–6 (7) |
Расчеты в соответствии с возрастом и долженствующим весом |
|||
0–3 мес. 115 |
2,2 |
13 |
6,5 |
|||
4–6 мес. 115 |
2,6 |
13 |
6,0 |
|||
7–12 мес. 110 |
2,9 |
13 |
5,5 |
|||
гипотрофия II степени |
||||||
Адаптационный |
2–5 дня |
n + 1, n + 2 |
Расчеты в соответствии с возрастом и фактической массой тела |
|||
Репарационный |
1–4 недели |
n+1, n+2, затем n = 5–6 (7) |
В соответствии с возрастом и долженствующим весом |
на фактический вес |
||
В соответствии с возрастом и долженствующим весом |
||||||
Усиленного питания |
6–8 недель |
по возрасту n = 5–6 (7) |
Расчеты в соответствии с возрастом и долженствующим весом |
|||
130–145 ккал /кг/ день |
5 г/кг/день |
14–16г/кг/день |
6,5г/кг/день |
|||
гипотрофия III степени |
||||||
Адаптационный |
10–14 дней |
1–2 день n=10 3–5 день n=7 6–7дней и > n= 5–6 |
120 ккал/кг/день |
1–2 г/кг/день |
Расчеты в соответствии с возрастом и фактическим весом |
|
Репарационный |
2–4 недели |
по возрасту n = 5–6 (7) |
В соответствии с возрастом и долженствующим весом |
на фактический вес |
||
В соответствии с возрастом и долженствующим весом |
||||||
Усиленного питания |
6–8 недель |
по возрасту n = 5–6 (7) |
Расчеты в соответствии с возрастом и долженствующим весом |
|||
130–145 ккал/кг/день |
5 г/кг/день |
14–16г/кг/день |
6,5/г/кг/день |
|||
Гипотрофия II степени преимущественно развивается при тяжелой врожденной или приобретенной патологии, недостаточное питание становится его причиной значительно реже.
Диетическая коррекция алиментарной гипотрофии II степени условно подразделяется на три периода: адаптационный период (определение толерантности к пище), репарационный период (промежуточный) и период усиленного питания.
В периоде адаптации (продолжительность 2–5 дней) расчет питания проводится на фактическую массу тела (табл. 30). Число кормлений увеличивается на 1–2 в сутки с соответствующим снижением объема каждого кормления, при необходимости дополнительно вводится жидкость (5% раствор глюкозы или солевые растворы для оральной регидратации). В этот период предпочтительно использование женского молока, при его недостатке или отсутствии — адаптированных детских молочных смесей, обогащенных пробиотиками, олигосахаридами и нуклеотидами. Возможно использование смесей с более высоким содержанием белка, например, специализированных молочных смесей для недоношенных и маловесных детей. При выявлении нарушений расщепления/всасывания пищевых ингредиентов целесообразно использование лечебных продуктов (например, низколактозных смесей при лактазной недостаточности, смесей с повышенной квотой среднецепочечных триглицеридов при мальабсорбции жиров). При отсутствииэффекта следует назначать смеси на основе высоко гидролизованного молочного белка со среднецепочечными триглицеридами.
Затем, при нормальной переносимости, начинается период репарации, когда объем питания постепенно (в течение 5–7 дней) увеличивается, при этом расчет нутриентов проводят на долженствующую массу тела. Сначала повышают углеводную и белковую составляющие рациона, и лишь в последнюю очередь — жировую.
Это становится возможным при введении прикорма. Первыми целесообразно назначать безмолочные каши промышленного производства, которые разводятся грудным молоком или смесью, которую получает ребенок, затем вводят мясное пюре, творог, желток. В этот период рекомендуется назначать ферментные препараты, поливитаминные комплексы и средства, положительно влияющие на обменные процессы (элькар, оротат калия, корилип, лимонтар, глицин и др).
Далее следует период усиленного питания, в течение которого ребенок получает высококалорийное питание (130–145 ккал/кг/сут.) в комплексе с лекарственными препаратами, улучшающими переваривание и усвоение пищи.
В случаях, когда гипотрофия II степени обусловлена тяжелым течением хронического заболевания и ребенок на момент обращения к врачу уже получает высококалорийную диету, проводится ревизия рациона. На фоне медикаментозного лечения основного заболевания и использования препаратов, способствующих улучшению переваривания и усвоения нутриентов, и средств, положительно влияющих на обменные процессы, назначаются специализированные продукты с повышенным содержанием легкоусвояемого белка и содержащие среднецепочечные триглицериды (смеси для недоношенных и маловесных детей, низколактозная молочная смесь «Хумана ЛП СЦТ», смеси на основе высоко гидролизованного белка с СЦТ). Постепенно, с 4 месячного возраста, вводятся продукты прикорма, преимущество следует отдавать кашам промышленного производства, для разведения которых используются указанные смеси. Особое внимание уделяется достаточному содержанию в рационах питания растительных масел, мясного пюре.
Гипотрофия III степени, как и гипотрофия II степени, как правило, возникает при тяжелых соматических и инфекционных заболеваниях. При этом резко нарушаются все виды обмена, состояние ребенка, как правило, бывает очень тяжелым, поэтому такие дети нуждаются в проведении интенсивной терапии, использовании энтерального и парентерального питания, что требует стационарного лечения.
Парентеральное питание начального периода должно быть обоснованным, сбалансированным и максимально кратковременным из-за опасности развития тяжелых осложнений. В первые дни используются аминокислотные препараты и растворы глюкозы, затем добавляются жировые эмульсии. Параллельно проводится парентеральная коррекция дегидратации, нарушений КЩС (как правило, ацидоза) и электролитных нарушений.
Наиболее оправданным видом энтерального питания при тяжелых формах гипотрофии является длительное энтеральное зондовое питание, которое заключается в непрерывном медленном поступлении питательных веществ в ЖКТ (желудок, двенадцатиперстную кишку, тощую кишку — капельно, оптимально — с помощью инфузионного насоса). Постоянное (или с небольшими интервалами) медленное введение специализированных продуктов абсолютно оправдано, так как энерготраты на переваривание и усвоение питательных веществ в этих условиях гораздо ниже, чем при порционном введении. При таком способе кормления улучшается полостное пищеварение, постепенно повышается всасывающая способность кишки и нормализуется моторика верхних отделов ЖКТ. Белковый компонент смесей для энтерального питания стимулирует секреторную и кислотообразующую функцию желудка, поддерживает адекватную экзокринную функцию поджелудочной железы и секрецию холицистокинина, обеспечивает нормальную моторику билиарной системы и предотвращает развитие таких осложнений, как билиарный сладж и холелитиаз.
Для энтерального питания у детей раннего возраста должны использоваться специализированные продукты. Наиболее оправданным является применение смесей на основе высоко гидролизованного молочного белка, не содержащих лактозу, обогащенных среднецепочечными триглицеридами («Алфаре», «Нутрилон Пепти ТСЦ», «Нутрилак Пептиди СЦТ», «Прегестимил»). Они обеспечивают максимальное усвоение питательных веществ в условиях значительного угнетения переваривающей и всасывающей способности пищеварительного канала (табл. 31). Энергетическая ценность указанных продуктов колеблется в пределах 0,66–0,70 ккал/мл, что при введении 1 литра обеспечит ребенку 660–700 ккал/сут.
| Нутриенты | Количество на кг массы тела/день |
|---|---|
Вода |
120–140 мл |
Энергия |
100 ккал |
Белок |
1–2 г |
Электролиты |
|
Натрий Калий Магний Фосфор Кальций |
1,0 ммоль (23 мг) 4,0 ммоль (160 мг) 0,6 ммоль (10 мг) 2,0 ммоль (60 мг) 2,0 ммоль (80 мг) |
Микроэлементы |
|
Цинк Медь Селен Йод |
30 микромоль (2,0 мг) 4,5 мкромоль (0,3 мг) 60 наномоль (4,7 мкг) 0,1 микромоль (12 мкг) |
Витамины водорастворимые |
|
В1 В2 Никотиамид В6 В12 Фолиевая кислота С Пантотеновая кислота Биотин |
70 мкг 0,2 мг 1 мг 70 мкг 0,1 мг 0,1 мг 10 мкг 0,3 мг 10 мг |
Витамины жирорастворимые |
|
А D Е К |
0,15 мг 3 мкг 2,2 мг 4 мкг |
При необходимости в первые дни лечебная смесь может разводиться в концентрации — 5–7 г сухого порошка на 100 мл воды (5–7% раствор). Далее постепенно доводят концентрацию смеси до 13,5% (физиологической), а при хорошей переносимости — до 15%. Недостающие калории, нутриенты и электролиты в период применения смеси в низкой концентрации компенсируются за счет парентерального питания.
Специализированным продуктом для энтерального питания детей первого года жизни является «Инфатрини». Эта готовая к употреблению высоко белковая и высоко энергетическая смесь может использоваться как перорально, так и для зондового питания (белки – 2,6 г, жиры – 5,4 г, углеводы – 10,3 г, энергетическая ценность – 100 ккал в 100 мл продукта).
Длительность периода постоянного энтерального зондового питания варьирует от нескольких дней до нескольких недель в зависимости от выраженности нарушенний толерантности к пище (анорексия, рвота, диарея). В течение этого периода адаптации постепенно повышается калорийность рациона до 120 ккал на кг фактической массы и осуществляется медленный переход на порционное введение питательной смеси — 10 раз, а затем 7–8 раз в течение дня с сохранением и равномерным распределением достигнутого объема.
С этой целью при переходе на дробное питание можно вначале оставлять постоянную инфузию на ночное время до того момента, когда порционное питание по калорийности не превысит 75% дневной нормы потребления.
В репарационный период осуществляется коррекция белков, углеводов и затем жиров, расчет производится на долженствующую массу тела, что приводит к повышению энергетической ценности рациона (табл. 30). В питание ребенка постепенно вводятся высококалорийные продукты прикорма, возможно введение адаптированных кисломолочных смесей.
При хорошей переносимости назначенного рациона на этапе усиленного питания калорийность увеличивается до 130–145 ккал/кг/сут на долженствующую массу тела, с повышенным содержанием нутриентов, но не более: белки — 5 г/кг/сут., жиры — 6,5 г/кг/сут., углеводы — 14–16 г/кг/сут. Средняя длительность этапа усиленного питания составляет 1,5–2 месяца.
Основным показателем адекватности диетотерапии является прибавка массы тела. Оптимальной считается прибавка, если она превышает 10 г/кг/сут., средней — 5–10 г/кг/сут. и низкой — менее 5 г/кг/сут.
В настоящее время причиной развития гипотрофии III степени у детей, как правило, является тяжелая хроническая соматическая патология, а не недостаточное питание, поэтому своевременная диагностика и лечение причинно-значимого заболевания является основополагающим фактором профилактики и лечения данного состояния.
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ ПРИ ГИПОТРОФИИ III СТЕПЕНИ
Помимо медикаментозной (парентеральной) коррекции обезвоживания и электролитных нарушений, в остром периоде необходимо помнить о необходимости своевременной диагностики возможной надпочечниковой недостаточности.
Начиная с периода репарации, целесообразна заместительная ферментотерапия препаратами поджелудочной железы. Предпочтение отдается микрокапсулированным препаратам. При дисбактериозе кишечника, проведении антибактериальной терапии назначаются биопрепараты.
Применение анаболических средств осуществляется с осторожностью, так как в условиях дефицита питательных веществ их использование может вызвать глубокие нарушения белкового и других видов обмена, угнетение ферментов пристеночного пищеварения. Показано применение витаминотерапии со стимулирующей и заместительной целью. На первых этапах лечения целесообразно парентеральное введение витаминных препаратов.
Лечение рахита, железодефицитной анемии проводится, начиная с периода репарации.
Показания к проведению стимулирующей и иммунотерапии определяются индивидуально. В периоды адаптации и репарации следует отдавать предпочтение пассивной иммунотерапии (иммуноглобулины). В период реконвалесценции могут назначаться неспецифические иммуностимуляторы.
Гипотрофия при неврологических нарушениях
Одной из причин гипотрофии у детей с тяжелыми неврологическими нарушениями является дисфагия. При тяжелой дисфагии, делающей невозможным питание через рот, используют назогастральный или назоеюнальный зонд, если питание будет продолжаться более трех недель рекомендуется наложение чрескожной гастростомы. При необходимости подключается парентеральное питание.
Основные требования к питанию детей с дисфагией — это использование питания с измененной текстурой (смеси с загустителями, гомогенезированные пюре, желеобразные формы пищи). Не следует назначать пищу, которая не формирует гладкий пищевой комок, например, рассыпчатые каши, горох, кукурузу, некоторые овощи. При организации питания необходимо обеспечить достаточное потребление всех пищевых веществ и энергии для нормального роста и развития детей.
Другой причиной развития гипотрофии у детей с тяжелыми неврологическими нарушениями являются частые обильные срыгивания и рвота. Подходы к ведению таких больных описаны в главе «Фукнциональные нарушения ЖКТ».
Для детей с неврологическими расстройствами (ДЦП) характерны также повышенные энерготраты, связанные с нарушением энергообмена, недостаточной регуляцией функций вегетативной нервной системы. Кроме того, гипотрофия может быть связана со снижением объема и массы мышечной ткани, особенно мышц конечностей.
Исследование характера вскармливания детей с ДЦП показало, что гипотрофия чаще развивается при традиционном питании, и что перевод этих детей на питание повышением энергетической плотности, осуществляемое с помощью назогастрального зонда помогает восстановить массу тела. Через зонд могут вводиться стандартные детские молочные смеси, антирефлюксные продукты или смеси для недоношенных детей. Однако целесообразнее использовать специализированные продукты на основе высоко гидролизованного белка, обогащенные СЦТ, которые легче усваиваются. Возможно использование жидких каш. Назначаются препараты, метаболического действия с анаболическим эффектом. Прибавка массы тела у больных с ДЦП при зондовом питании обусловлена преимущественно отложением жира, так как восстановление мышечной ткани без активной работы конечностей невозможно. После курса зондового питания ребенок переводится на питание через рот с использованием высококалорийных продуктов.
Гипотрофия, связанная с повышенной потребностью детей в энергии и пищевых веществах развивается у детей при бронхолегочной дисплазии (БЛД), тяжелых пороках сердца и некоторых других заболеваниях.
Сочетание глубокой недоношенности и бронхолегочной дисплазии формирует особые потребности детей в нутриентах, необходимых не только для скачка роста и развития, но и для восстановления целостности поврежденных вследствие заболевания эпителиальных клеток. Большую роль в развитии гипотрофии играет катаболическое влияние дексаметазона на метаболизм белка, а также на систему «гормон роста — инсулиноподобный фактор роста».
Особенности питания детей с БЛД включают два основных подхода:
-
увеличение энергетического обеспечения с одновременным снижением потребления жидкости;
-
модификация состава детского питания со снижением углеводного компонента и повышением энергетической ценности рациона за счет увеличения липидов.
В настоящее время ведется разработка специальной смеси для больных БЛД после выписки из стационара, которая, по мнению исследователей, должна обеспечивать высокое поступление энергии (910 ккал/л), высокий уровень белка (6 г/100 ккал), более высокий уровень инозитола, витамина А, витамина Е, полиненасыщенных жирных кислот.
Врожденные пороки сердца (ВПС) у детей часто приводят к развитию гипотрофии. Среди факторов развития гипотрофии у детей с ВПС следует выделить: сниженное потребление калорий (сниженный аппетит, повышенная утомляемость), синдром мальабсорбции вследствие нарушения кровоснабжения кишки, гиперметаболизм (вследствие тахикардии, одышки, тахипноэ). Более выраженная гипотрофия развивается у больных с «синими» пороками и легочной гипертензией, а также у больных с тяжелыми нарушениями гемодинамики.
Принципы нутритивной поддержки детей с ВПС основаны на стратегии обеспечения большей калорийности рациона и поступления более высокого уровня белка, коррекцию потребления железа, цинка, кальция, витаминов D, Е, С, В1 и В6, использование препаратов, улучшающих метаболизм. При выраженной недостаточности кровообращения необходимость в ограничении жидкости (на 1/4–1/3 суточного объема) диктует целесообразность использования молочных смесей в повышенной на 15–30% концентрации (в 90 мл воды вносятся не 3, а 3,5–4 мерные ложки). При естественном вскармливании назначаются «усилители» женского молока или проводится смешанное питание с введением в рацион продуктов для недоношенных детей или смесей на основе гидролизата белка с СЦТ.
9. ДИЕТОТЕРАПИЯ И ДИЕТОПРОФИЛАКТИКА ПИЩЕВОЙ АЛЛЕРГИИ [10]
Пищевая аллергия (ПА) — состояние повышенной чувствительности к пищевым продуктам, в основе которой лежат иммунологические механизмы, ведущими при этом являются IgE-опосредованные реакции.
МКБ-10 — при кодировании пищевой аллергии используют коды основных симптомов, выявляемых у больных.
Наибольшая распространенность пищевой аллергии отмечается у детей первых 2-х лет жизни и составляет 6–8%. В настоящее время установлено более 160 пищевых аллергенов, вызывающих IgE-опосредованные аллергические реакции у детей. В «большую восьмерку» продуктов, обладающих наибольшей аллергенностью, входят: коровье молоко, яйцо, рыба, пшеница, арахис, соя, ракообразные (креветки, крабы, лобстеры и другие), орехи (лесные, миндаль, грецкие). К широко распространенным аллергенам относятся также какао и шоколад, цитрусовые, клубника, земляника, мед, мясо животных и птиц, икра и другие морепродукты, злаки.
У детей первого года жизни одним из первых аллергенов, вызывающих развитие пищевой аллергии, является коровье молоко. В нем содержится 15–20 антигенов, из которых наиболее аллергенными являются: казеин, b-лактоглобулин, a-лактальбумин, бычий сывороточный альбумин. Ингредиенты коровьего молока (казеин, сывороточные белки) могут присутствовать во многих пищевых продуктах. Известно, что среди детей первого года жизни аллергия к белкам коровьего молока (БКМ) встречается у 0,5–1,5 % младенцев, находящихся на естественном вскармливании, и до 2–5% — на искусственном вскармливании. У больных атопическим дерматитом в 70–85% случаев выявляется аллергия к БКМ.
Аллергические реакции, связанные с приемом пищевых продуктов, могут проявляться множеством симптомов, обусловленных вовлечением в патологический процесс различных органов и систем. Для детей раннего возраста наиболее характерными являются кожные проявления аллергии (атопический дерматит, упорные опрелости и потница, отек Квинке, крапивница), а также различные гастроинтестинальные нарушения — обильные срыгивания и рвота, колики, изменение характера стула — диарея или запоры. К более редким проявлениям пищевой аллергии относятся расстройства со стороны органов дыхания (ринит, приступы затрудненного дыхания, апное) и тяжелые общие анафилактические реакции.
Диагностика
Диагностика пищевой аллергии основана на тщательном сборе аллергологического анамнеза и оценке клинической симптоматики.
Для верификации диагноза проводится аллергологическое обследование — определение уровней специфических антител — IgE и IgG4 в сыворотке крови, кожные пробы, провокационные тесты. Выявление (тем или иным способом) сенсибилизации к пищевым аллергенам является показанием для частичного или полного исключения из питания ребенка продуктов, содержащих непереносимый белок.
Диетотерапия
При пищевой аллергии диетотерапия служит важнейшей составляющей комплексной терапии, поскольку является патогенетическим методом лечения. Правильно построенное питание позволяет снизить лекарственную нагрузку на организм ребенка, способствует более быстрому достижению и поддержанию ремиссии заболевания.
Диетотерапия строится по индивидуальному плану, исходя из клинических проявлений аллергии, спектра выявленной сенсибилизации, возраста, нутритивного статуса ребенка, функционального состояния органов пищеварения, а также характера предшествующего питания.
Диета при пищевой аллергии базируется в первую очередь на принципе элиминации. В периоде клинических проявлений заболевания диета должна быть максимально строгой и предусматриватьисключение или ограничение причинно-значимых и перекрестно реагирующих аллергенов и элиминацию продуктов, обладающих высокой сенсибилизирующей активностью, с их адекватной заменой.
В стадии ремиссии рацион ребенка постепенно расширяют за счет ранее исключенных продуктов и блюд. Вместе с тем, независимо от периода болезни, диета должна обеспечивать физиологические потребности детей в основных пищевых веществах, энергии, витаминах, минералах и, несмотря на строгий характер кулинарной обработки, сохранять высокую пищевую и биологическую ценность. Продукты и блюда должны иметь хорошие органолептические свойства.
В случаях выявления ПА у детей, находящихся на естественном вскармливании, учитывая уникальные свойства материнского молока, необходимо сохранить его в питании ребенка в максимальном объеме. Кормящей женщине назначают гипоаллергенную диету, при этом степень ограничений и набор продуктов достаточно индивидуальны и зависят в первую очередь от тяжести клинических проявлений аллергии у ребенка и наличия аллергической патологии у матери. Особенностью данной диеты является элиминация продуктов, обладающих высокой сенсибилизирующей активностью, а также продуктов с высоким содержанием экстрактивных веществ и пуриновых оснований — лука, чеснока, редьки, редиса, мясных, рыбных, грибных и куриных бульонов, острых приправ. Молочные продукты применяются ограниченно в виде кисломолочных напитков, сметаны и неострых сортов сыра. При наличии клинических данных в пользу аллергии на БКМ у ребенка матери может назначаться и безмолочная диета с полным исключением молочных продуктов, в связи с возможностью проникновения в женское молоко цельных молекул белков коровьего молока. Для формирования полноценного рациона целесообразно использование специализированных продуктов для кормящих матерей на основе изолята соевого белка. Количество круп и макаронных изделий, пшеничного хлеба, сахара уменьшается на 20–25%, соли — на 30% (табл. 32).
| Исключаются | Ограничиваются | Разрешаются |
|---|---|---|
- Высокоаллергенные продукты – рыба, икра, морепродукты (раки, крабы, креветки, крабовые палочки, закусочные консервы), яйца, грибы, орехи, мед, шоколад, кофе, какао - Цельное молоко, сливки, кисломолочные продукты с ароматизаторами и фруктовыми наполнителями, глазированные сырки - Тропические плоды, клубника, малина |
- Цельное молоко (только в каши), сметана в блюда - Абрикосы, персики, дыня, вишня, черешня, смородина, слива - Хлеб, хлебобулочные и макаронные изделия из муки высшего сорта, манная крупа - Кондитерские изделия, сладости - Сахар — до 40 г - Соль |
- Кисломолочные продукты (Биобаланс, кефир, бифидок, ацидофилин, йогурты без фруктовых добавок и др.) - Крупы (гречневая, кукурузная, рисовая, овсяная и др.) - Овощи и фрукты (яблоки, груши, кабачки, патиссоны, цветная, брюссельская, белокочанная капуста, брокколи, картофель и др.) - Супы — вегетарианские - Мясо — нежирные сорта говядины, свинины; филе индейки, цыплят в отварном, тушеном виде, а также в виде паровых котлет - Хлеб — пшеничный 2-го сорта, ржаной, пшеничноржаной - Напитки — чай, компоты, морсы без сахара |
Гипоаллергенную диету кормящим матерям назначают на весь период кормления ребенка грудью. При этом необходимо обеспечить высокую пищевую и биологическую ценность ее рациона за счет достаточного поступления животного белка, жиров, углеводов, витаминов, минеральных веществ, что является необходимым условием для поддержания лактации. Для обогащения питания матери следует использовать витаминно-минеральные комплексы, а также продукты с пробиотическими свойствами (например, «Биобаланс с LGG», Россия).
При недостатке или отсутствии грудного молока в питании ребенка с аллергией к белку коровьего молока используются безмолочные лечебные смеси. Согласно современным рекомендациям, в период клинических проявлений аллергии (острый период атопического дерматита, желудочно-кишечные симптомы), безусловно, наиболее целесообразным является назначение аминокислотных смесей, таких как «Неокейт», или смесей на основе высоко гидролизованного молочного белка – как продуктов, практически лишенных антигенных свойств: «Алфаре», «Нутрилак Пептиди СЦТ», «Нутрилон Пепти ТСЦ», «Прегестимил», «Нутрамиген», «Фрисопеп АС» и др. (табл. 33).
Название |
Фирма-производитель, страна |
Ингредиенты, г |
Энергетическая ценность, ккал |
||
белки |
жиры |
углеводы |
|||
Лечебные смеси на основе высокогидролизованных молочных белков |
|||||
Алфаре† |
Нестле, Швейцария |
2,1 |
3,56 |
7,65 |
70 |
Нутрамиген |
Мид Джонсон, США |
1,9 |
3,7 |
7,5 |
68 |
Прегестимил† |
Мид Джонсон, США |
1,9 |
3,8 |
6,9 |
68 |
Нутрилак Пептиди СЦТ† |
Нутритек, Россия |
1,9 |
3,5 |
6,7 |
66 |
Нутрилон Пепти ТСЦ†* |
Нутриция, Голландия |
1,8 |
3,6 |
6,9 |
67 |
Фрисопеп |
Фризленд Фудс, Голландия |
1,5 |
3,5 |
7,2 |
67 |
Фрисопеп АС |
Фризленд Фудс, Голландия |
1,5 |
3,5 |
7,2 |
67 |
Гипоаллергенные смеси на основе частично (умеренно) гидролизованного молочного белка |
|||||
НАН ГА 1*, ** |
Нестле, Швейцария |
1,5 |
3,4 |
7,6 |
67 |
НАН ГА 2*, ** |
Нестле, Швейцария |
1,85 |
3,0 |
8,1 |
67 |
Нутрилак ГА |
Нутритек Россия |
1,6 |
3,4 |
7,1 |
66 |
Нутрилон ГА 1*,*** |
Нутриция, Голландия |
1,6 |
3,5 |
7,3 |
67 |
Нутрилон ГА 2*** |
Нутриция, Голландия |
1,8 |
3,5 |
7,9 |
70 |
Тема ГА 1 |
Юнимилк, Россия |
1,5 |
3,1 |
7,6 |
65 |
Тема ГА 2 *** |
Юнимилк, Россия |
1,6 |
3,2 |
7,9 |
67 |
Фрисолак ГА 1 *, **, *** |
Фризленд Фудс, Голландия |
1,5 |
3,5 |
7,2 |
67 |
Фрисолак ГА 2 *, **, *** |
Фризленд Фудс, Голландия |
1,8 |
3,3 |
9,0 |
74 |
Хумана ГА 1* |
Хумана, Германия |
1,5 3, |
1 |
7,7 |
65 |
Хумана ГА 2*** |
Хумана, Германия |
1,6 |
3,2 |
7,9 |
67 |
Хумана ГА 3*** |
Хумана, Германия |
1,6 |
3,3 |
8,2 |
69 |
ХиПП ГА 1 ХиПП, |
Австрия |
1,8 |
4,0 |
7,4 |
73 |
ХиППГА2 ХиПП, |
Австрия |
2,2 |
4,4 |
7,4 |
78 |
Смеси на основе свободных аминокислот |
|||||
Неокейт |
Нутриция, Голландия |
1,95 |
3,5 |
8,1 |
71 |
† — содержат среднецепочечные триглицериды; * — длинноцепочечные полиненасыщенные жирные кислоты; ** — бифидобактерии; *** — олигосахариды
По сравнению с протеинами коровьего молока, имеющими молекулярную массу от 10 до 60 кDa, аллергенность белкового компонента продуктов, созданных на основе высоко гидролизованного белка, снижена в 10 000–100 000 раз. Однако и в их составе возможно сохранение остаточных количеств белковых антигенов. Так, пептиды с молекулярной массой 3,5 кDa в отдельных случаях могут вызывать аллергические реакции немедленного типа, а пептиды с молекулярной массой более 6 кDa расцениваются как потенциальные аллергены, способные вызвать тяжелые аллергические реакции у больных с пищевой непереносимостью. Молекулярный вес пептидов, ниже которого аллергенность белкового гидролизата становится минимальной, составляет 1,5 кDa. Аминокислотная смесь синтезируется de novo из свободных аминокислот, поэтому полностью лишена белковой специфичности и исключает риск контакта ребенка с аллергенами белков коровьего молока.
Все продукты данной группы обогащены комплексом витаминов, макро- и микроэлементов и соответствуют требованиям ВОЗ по ингредиентному составу, биологической и пищевой ценности, влиянию на физическое и психомоторное развитие детей первого года жизни (табл. 33).
Продукты, созданные на основе высоко гидролизованного белка, отличаются по исходному субстрату, подвергаемому гидролизу Выделяют смеси на основе гидролизата сывороточных белков («Алфаре», «Нутрилак Пептиди СЦТ», «Нутрилон Пепти ТСЦ», «Фрисопеп») и гидролизата казеина («Прегестимил», «Нутрамиген», «Фрисопеп АС»). Между ними имеются определенные различия в жировом и углеводном компонентах. Учет особенностей каждой смеси позволяет подобрать продукт в соответствии с индивидуальными особенностями клинической картины заболевания.
В состав липидного компонента лечебных смесей «Алфаре», «Нутрилак Пептиди СЦТ», «Нутрилон Пепти ТСЦ», «Прегестимил», предназначенных в первую очередь для детей с гастроинтестинальными проявлениями ПА и синдромом мальабсорбции, введены среднецепочечные триглицериды (до 50% общего количества липидов), которые легко всасываются в систему воротной вены, минуя лимфатические сосуды, не требуя эмульгирования и участия панкреатической липазы.
Необходимо также учитывать наличие или отсутствие лактозы в составе углеводного компонента смеси, поскольку аллергия к белкам коровьего молока нередко сопровождается частичной или полной непереносимостью лактозы. В таких случаях целесообразно назначать смесь на основе высоко гидролизованного белка, низколактозную или не содержащую лактозу.
Еще одной группой продуктов, используемых в питании детей с аллергией к белкам коровьего молока, являются соевые смеси. В состав данных продуктов, помимо изолята соевого белка, входят растительные масла, декстрин-мальтоза, витаминно-минеральный комплекс в соответствии с физиологическими потребностями детей первого года жизни (табл. 34).
Название |
Фирма-производитель, страна |
Ингредиенты, г |
Энергетическая ценность, ккал |
||
белки |
жиры |
углеводы |
|||
Нутрилак Соя |
Нутритек, Россия |
1,8 |
3,6 |
6,7 |
67 |
Нутрилон Соя |
Нутриция, Голландия |
1,6 |
3,5 |
7,0 |
66 |
Фрисосой |
Фризленд Фудс, Голландия |
1,7 |
3,5 |
7,1 |
67 |
Хумана СЛ |
Хумана, Германия |
1,6 |
3,3 |
7,9 |
67 |
Энфамил Соя |
Мид Джонсон, США |
2,0 |
3,6 |
6,5 |
67 |
Поскольку данные смеси содержат нативный белок и потенциально аллергены, применение их у детей с ПА ограничено. Данные смеси не следует применять в остром периоде клинических проявлений, при наличии сенсибилизации к сое, детям младше 5–6 месяцев, при наличии гастроинтестинальных проявлений аллергии. Выполнение перечисленных правил позволяет избежать развития сенсибилизации к соевому белку и появления аллергических реакций (рис. 4).
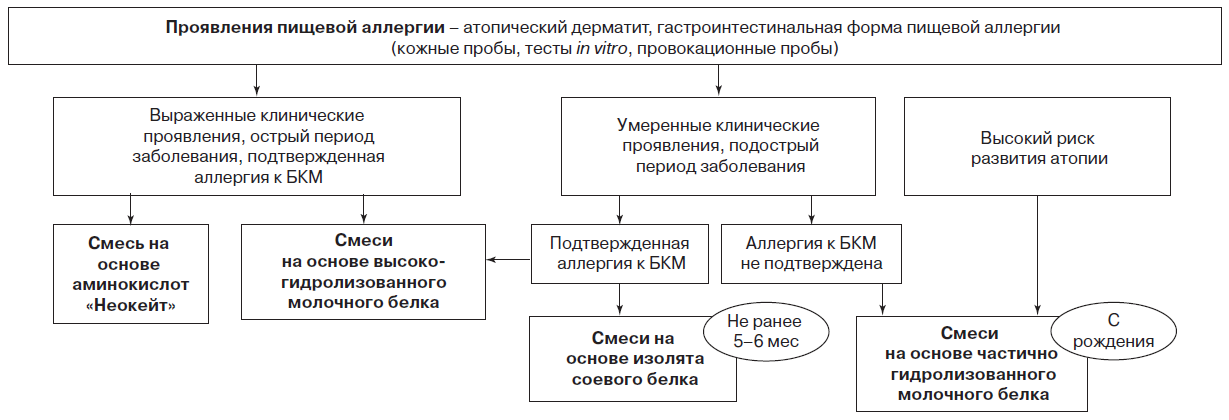
Адаптированные смеси на основе козьего молока, учитывая высокую частоту перекрестных аллергических реакций между белками козьего и коровьего молока, возможно применять на втором этапе диетотерапии — этапе расширения рациона.
Длительность элиминации молочных смесей и молочных продуктов из питания детей с пищевой аллергией индивидуальна. Минимальная продолжительность безмолочного питания у детей с аллергией к БКМ составляет 3–6 месяцев, в отдельных случаях это может продолжаться до одного года и более.
Молочные продукты вводят в рационы детей, начиная со смесей на основе частично гидролизованного белка («Нутрилак ГА», «Нутрилон ГА» 1 и 2, «НАН ГА» 1 и 2, «Фрисолак ГА» 1 и 2, «Хумана ГА» 1, 2 и 3, «ХиПП ГА» 1 и 2), аллергенность которых снижена в 300–1000 раз, отдельных продуктов – до 7000 раз («Тёма ГА 1» и «Тёма ГА 2»). Осуществляют это в период клинико-лабораторной ремиссии заболевания, постепенно, учитывая возможность развития повторных аллергических реакций.
Кисломолочные и пробиотические продукты используют в питании детей с аллергией к белку коровьего молока только на втором этапе диетотерапии — в период расширения безмолочного рациона. Применение продуктов, содержащих пробиотики (НАН кисломолочный, безмолочные каши функционального назначения «Помогайка»), позволяет целенаправленно воздействовать на состав биоценоза кишечника и состояние иммунологической защиты организма, что приобретает большое значение при наличии частых инфекций или инфекционных осложнений аллергического заболевания.
При назначении прикорма больным с пищевой аллергией необходимо учитывать остроту, тяжесть и форму аллергического заболевания, возраст ребенка, его нутритивный статус, выявленные причинно-значимые пищевые аллергены, сопутствующие заболевания. Необходимо строго индивидуально подбирать продукты и блюда прикорма, начинать прикорм с монокомпонентных продуктов и блюд промышленного производства, использовать продукты с низкой аллергизирующей активностью, соблюдать национальные традиции в питании.
Сроки назначения продуктов и блюд прикорма больным, страдающим пищевой аллергией, несколько отличаются от таковых у здоровых детей (табл. 35).
| Продукты | Возраст, мес* |
|---|---|
Фруктовые, ягодные соки |
6 |
Фруктовые пюре |
5,5 |
Творог |
– |
Желток |
– |
Пюре овощное |
5 (безмолочное) |
Масло растительное |
5 |
Каша |
5,5 (безмолочная, на соевой смеси или гидролизате) |
Масло сливочное |
5,5 (топленое) |
Пюре мясное |
6 |
Кефир |
Не ранее 8 (при отсутствии сенсибилизации) |
Сухари, печенье |
7 (не сдобные) |
Хлеб пшеничный |
9 (батоны из муки 2-го сорта, пшенично-ржаной) |
Рыба |
– |
*— Необходим строгий учет индивидуальной переносимости продуктов, вводимых в питание.
Используются безмолочные, безглютеновые каши (гречневая, кукурузная, рисовая). Каши разводят водой или специализированной смесью, которую получает ребенок (на основе гидролизата молочного белка или изолята соевого белка). В состав овощного пюре включают кабачки, патиссоны, цветную, белокочанную, брюссельскую капусту и другие виды светлоокрашенных овощей, предпочтительно в виде консервов для детского питания. К овощному пюре добавляют растительные масла (подсолнечное, кукурузное, оливковое).
С целью коррекции белковой части рациона в питание ребенка, страдающего пищевой аллергией, с 6 месяцев вводят мясное пюре. При непереносимости говядины, имеющей антигенное сродство с белками коровьего молока, рекомендуется использовать специализированные детские консервы из мяса кролика, индейки, конины, нежирной свинины.
Из фруктов предпочтение отдают яблокам зеленой и белой окраски (антоновские, симиренко, белый налив). С учетом индивидуальной переносимости используют груши, белую и красную смородину, желтую и красную черешню, желтые сливы или детские соки и пюре из них. Тепловая обработка фруктов и ягод улучшает их переносимость.
Творог, яйца и рыба в рационы детей первого года жизни с пищевой аллергией не вводятся или полностью элиминируются.
В дальнейшем ребенок получает гипоаллергенную диету, целью которой является уменьшение антигенного и гистамино-либераторного воздействия пищи и улучшение или нормализация процессов пищеварения, что позволяет добиться более длительной и стойкой ремиссии заболевания. При достижении ремиссии аллергического заболевания гипоаллергенная диета должна постепенно расширяться. Высоко аллергенные продукты (рыба, орехи, шоколад, мед, кофе, какао, грибы и т.п.) не вводятся в рацион детей в течение продолжительного времени.
При правильно подобранном питании клинико-лабораторная ремиссия аллергического заболевания, обусловленного гиперчувствительностью к белкам коровьего молока, у 80–90% детей наступает к 2–3 годам. Однако, по данным некоторых авторов, у 15–20% больных с аллергией к белкам коровьего молока она может сохраняться до 9–14 лет и старше. При этом симптомы атопических проявлений могут варьировать от легких до очень тяжелых. Для уточнения диагноза проводят провокационные тесты (метод двойной слепой нагрузки с плацебо или открытые провокационные пробы).
Диетопрофилактика пищевой аллергии у детей раннего возраста
Чрезвычайно перспективным направлением детской аллергологии и нутрициологии является разработка мер профилактики — комплекса мероприятий, направленных на предупреждение возникновения атопии у грудных детей с генетически детерминированным высоким «риском».
Развитие пищевой аллергии при определенных условиях можно предотвратить или устранить на самых ранних этапах формирования. Возможность выявления детей с повышенным риском развития аллергических реакций позволяет предпринимать соответствующие профилактические меры еще до рождения ребенка.
Для ранней профилактики аллергической патологии Международная ассоциация аллергологов и клинических иммунологов и Всемирная Организация Здравоохранения считают необходимым: знание основных причин формирования атопии у детей; выделение групп высокого «риска» по ее развитию; максимально отсроченное введение высоко аллергенных продуктов или их полная элиминация из питания грудных детей с наследственной предрасположенностью к развитию атопических заболеваний; устранение контактов с неблагоприятными факторами окружающей среды, прежде всего с табачным дымом.
Диетопрофилактика является важным методом предупреждения развития аллергии. Однако эффективность элиминационных диет во время беременности в качестве профилактических мер в плане снижения риска аллергии в настоящее время продолжает дискутироваться. Зарубежные исследователи чаще признают необходимость проведения только постнатальной профилактики, ссылаясь на отсутствие убедительных доказательств профилактического эффекта специальной диеты матери в течение беременности для предупреждения развития аллергического заболевания у ребенка.
Однако большой научно-практический опыт отечественной школы детских нутрицилогов и педиатров указывает на важность соблюдения сбалансированной гипоаллергенной диеты, содержащей полноценный белок, обогащенной витаминами, минеральными веществами, в первую очередь кальцием, полиненасыщенными жирными кислотами и другими незаменимыми факторами питания, необходимыми для адекватного состояния беременной женщины и развивающегося плода.
Важным фактором профилактики аллергии является естественное вскармливание. Грудное молоко содержит компоненты гуморального и клеточного иммунитета и обеспечивает иммунологическую защиту ребенка не только от пищевых антигенов, но и от инфекций дыхательного и желудочно-кишечного тракта. Сохранение грудного вскармливания до 4–6 месяцев жизни существенно уменьшает риск возникновения аллергической патологии у ребенка.
При невозможности осуществления естественного вскармливания в целях профилактики аллергии необходимо отсрочить контакт ребенка с белками коровьего молока. Для этого в питании детей используют специализированные смеси, созданные на основе гидролизатов молочного белка.
Необходимость применения данных продуктов в питании детей, предрасположенных к аллергии, при недостатке или отсутствии материнского молока в настоящее время не вызывает сомнений. Однако продолжает дискутироваться вопрос о предпочтительном использовании частично гидролизованных смесей или высоко гидролизованных формул для профилактики аллергии у детей из группы высокого «риска» по развитию атопии. Высоко гидролизованные смеси обеспечивают более существенную защиту от аллергии в раннем возрасте. Вместе с тем, предполагается, что использование частичных гидролизатов («НАН ГА» 1 и 2, «Нутрилак ГА», «Нутрилон ГА» 1 и 2, «Тёма ГА» 1 и 2, «Фрисолак ГА» 1 и 2, «ХиПП ГА» 1 и 2, «Хумана ГА» 1, 2, 3 и др.), в отличие от высоко гидролизованных смесей, обеспечивает формирование оральной толерантности. Полагают, что введенные в более поздний период цельные молочные продукты не спровоцируют аллергическую сенсибилизацию к интактным протеинам. Кроме того, частично гидролизованные смеси более физиологичны по сравнению с продуктами, созданными на основе высоко гидролизованного белка, так как содержат лактозу, которая стимулирует рост бифидобактерий, способствует всасыванию ряда минеральных веществ: кальция, магния, марганца, кроме того, является источником галактозы, необходимой для синтеза галактоцереброзидов головного мозга, участвующих в миелинизации нейронов. Преимуществом гипоаллергенных смесей является не только низкая аллергенность, но и лучшие вкусовые качества и относительно меньшая стоимость.
Кроме того, употребление с рождения продуктов, не содержащих лактозу, в целях профилактики аллергии, может приводить к ложноотрицательным результатам большинства неонатальных тестов на галактоземию.
С большой осторожностью следует относиться к введению прикорма детям из групп «высокого риска» по развитию аллергических заболеваний. Его введение целесообразно начинать в возрасте 5–6 месяцев.
Выбор первого прикорма должен быть индивидуальным в зависимости от состояния здоровья ребенка. При назначении прикорма предпочтение следует отдавать продуктам с низким аллергизирующим потенциалом: светлым сортам ягод, фруктов и овощей, гипоаллергенным безмолочным безглютеновым кашам, свинине, конине, индейке, мясу кролика. Целесообразно использовать специализированные детские консервы промышленного производства. В период начала введения прикорма следует ограничить ассортимент вводимых продуктов (например, только 1 вид зерновых, 1–2 овоща, 1–2 фрукта, 1 вид мяса).
10. ФУНКЦИОНАЛЬНЫЕ НАРУШЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА У ДЕТЕЙ ГРУДНОГО ВОЗРАСТА И ИХ ДИЕТОЛОГИЧЕСКАЯ КОРРЕКЦИЯ [11]
Анатомо-физиологические особенности пищеварительного тракта, характерные для детей первого года жизни, могут способствовать развитию состояний, которые получили название «функциональных нарушений пищеварения».
Для них характерно наличие клинических симптомов при отсутствии органических изменений со стороны желудочно-кишечного тракта (ЖКТ): структурных аномалий, воспалительных изменений, опухолей, инфекции. Функциональные нарушения ЖКТ связаны с изменением моторной функции, иногда сопровождаются нарушениями секреции и всасывания. К наиболее распространенным функциональным нарушениям ЖКТ у детей первого года жизни относятся: синдром срыгиваний, кишечные колики и функциональные запоры, функциональная задержка стула и дисхезия.
СРЫГИВАНИЯ
Срыгивания (регургитация) — самопроизвольный заброс желудочного или желудочно-кишечного содержимого в ротовую полость.
У детей первого года жизни они могут быть вызваны различными причинами.
Срыгивания без органических изменений со стороны ЖКТ: быстрое сосание, аэрофагия, перекорм, нарушение режима кормления, неадекватный подбор смесей, синдром вегето-висцеральных нарушений при церебральной ишемии (пилороспазм, халазия кардии), дискинезия ЖКТ, ранний переход к густой пище, наследственные заболевания, связанные с нарушением обмена веществ
Срыгивания и рвота вследствие органических нарушений: врожденные пороки развития ЖКТ (дивертикулы пищевода, пилоростеноз, незавершенный поворот кишечника и др.), натальная травма шейного отдела позвоночника, эзофагит, гастродуоденит.
Для клинической характеристики выраженности синдрома срыгиваний, согласно рекомендациям группы экспертов ESPGHAN, предложено оценивать интенсивность срыгиваний по пятибалльной шкале, отражающей совокупную характеристику частоты и объема срыгиваний (табл. 36).
0 баллов |
Отсутствие срыгиваний |
1 балл |
Менее 5 срыгиваний в сутки, объемом не более 3 мл |
2 балла |
Более 5 срыгиваний в сутки, объемом более 3 мл |
3 балла |
Более 5 срыгиваний в сутки, объемом до 1/2 количества смеси, введенного за одно кормление, не чаще, чем в половине кормлений |
4 балла |
Срыгивания небольшого объема в течение 30 мин и более после каждого кормления |
5 баллов |
Срыгивания от 1/2 до полного объема смеси, введенного во время кормления, менее чем в половине кормлений |
Часто срыгивания не расцениваются как заболевания, поскольку они не вызывают выраженных изменений в состоянии здоровья детей. Необходимость коррекции синдрома срыгиваний обусловлена возможными осложнениями этого состояния. У детей с упорными срыгиваниями (оценка от 3 до 5 баллов) нередко отмечается не только отставание в физическом развитии, но и диагностируется железодефицитная анемия, а также выявляется высокая частота патологии пищеварительного тракта, заболеваний ЛОР органов и респираторных заболеваний в возрасте до 3 лет. Для них характерен беспокойный сон и повышенная возбудимость.
ДИАГНОСТИКА
Наиболее информативным с дифференциально-диагностической точки зрения методом обследования детей, страдающих упорными срыгиваниями, является эзофагогастродуоденоскопия. Это обследование позволяет оценить состояние слизистой оболочки, состоятельность кардиального сфинктера и др. При необходимости проводится прицельная биопсия слизистой оболочки пищевода и желудка. Гистологическое исследование помогает в максимально ранние сроки определить степень выраженности воспалительного процесса.
Углубление наших знаний, совершенствование методик и оборудования позволяет в настоящее время использовать для уточнения причин срыгиваний и рвоты ультразвуковое исследование. Возможно мониторирование моторной функции ЖКТ. Рентгенологическое исследование является важным не только в диагностическом отношении, но и в определении точной локализации патологического процесса, а также выборе тактики хирургического вмешательства.
У детей с тяжелыми формами срыгиваний с целью дифференциальной диагностики используют 24-часовую внутрипищеводную рН-метрию. Этот метод позволяет выявить общее число эпизодов рефлюкса, их длительность, мониторировать уровень кислотности в пищеводе.
ЛЕЧЕНИЕ
Лечение синдрома упорных срыгиваний (функциональных) включает ряд этапов:
-
разъяснительная работа и психологическая поддержка родителей;
-
позиционная (постуральная) терапия;
-
диетотерапия, основанная на использовании смесей с загустителем;
-
лекарственная терапия (патогенетическая и посиндромная) — спазмолитики, препараты, улучшающие мозговой кровоток энерготропные препараты на основе карнитина (Элькар, Карнитен, Карнитон), прокинетики (Мотилиум), антациды, пробиотики, ферменты и др.;
-
немедикаментозное лечение: лечебный массаж, упражнения в воде, сухая иммерсия, музыкотерапия, ароматерапия, аэроионотерапия.
Необходимо проводить разъяснительную работу с родителями, оказывать им психологическую поддержку, объяснять, что срыгивание является возрастной особенностью маленьких детей и не представляет опасности для их развития.
Постуральная терапия (изменение положения тела ребенка) направлена на уменьшение степени рефлюкса и способствует очищению пищевода от желудочного содержимого, снижая риск возникновения эзофагита и аспирационной пневмонии. Кормление ребенка должно происходить в позе сидя, при положении тела под углом 45–60°.Удерживать ребенка в вертикальном положении после кормления следует не менее 20–30 минут. Постуральное лечение должно осуществляться не только на протяжении всего дня, но и ночью, когда нарушается очищение нижнего отдела пищевода от аспирата вследствие отсутствия перистальтических волн (вызванных актом глотания) и нейтрализующего эффекта слюны.
Важная роль в лечении регургитаций принадлежит диетотерапии, которая зависит от вида вскармливания ребенка.
При естественном вскармливании необходимо создать спокойную обстановку для кормящей матери, направленную на сохранение лактации, нормализовать режим кормления ребенка, исключающий перекорм и контролировать правильное прикладывание к груди для профилактики аэрофагии. Поскольку срыгивания могут быть проявлением пищевой непереносимости, то матери при необходимости назначается гипоаллергенная диета.
Срыгивания нередко обусловлены неврологическими нарушениями вследствие перенесенного перинатального поражения центральной нервной системы, в таком случае диетологическая коррекция должна сочетаться с медикаментозным и немедикаментозным лечением данной патологии.
При отсутствии эффекта от выше описанных мероприятий, при упорных срыгиваниях используют «загустители грудного молока» — для этого в небольшую порцию сцеженного грудного молока добавляют безмолочную рисовую кашу или рисовый отвар, которые дают ребенку непосредственно перед кормлением.
Важно помнить, что даже упорные срыгивания не являются показанием для перевода ребенка на смешанное или искусственное вскармливание. Обычно к трем месяцам число эпизодов срыгиваний значительно уменьшается, а если упорные срыгивания сохраняются, то ребенок нуждается в дополнительном обследовании и сочетании диетического лечения с патогенетической терапией.
При искусственном вскармливании необходимо обратить внимание на режим кормления ребенка, на адекватность выбора молочных смесей, на их объем, который должен соответствовать возрасту и массе тела ребенка. Дети должны получать современные адаптированные молочные смеси.
Название |
Фирма-производитель, страна |
Ингредиенты, г |
Энергетическая ценность, ккал |
||
белки |
жиры |
углеводы |
|||
Содержат камедь |
|||||
Бабушкино лукошко Антирефлюкс БИО |
NUTRIBIO, Франция |
1,47 |
3,5 |
7,52 |
66 |
Нутрилак АР |
Нутритек, Россия |
1,5 |
3,4 |
6,9 (0,34*) |
65 |
Нутрилон АР † |
Нутриция, Голландия |
1,6 |
3,5 |
7,0 (0,42*) |
66 |
Фрисовом 1 |
Фризленд Фудс, Голландия |
1,4 |
3,4 |
7,6 (0,50*) |
64 |
Фрисовом 2 |
Фризленд Фудс, Голландия |
1,8 |
3,2 |
8,9 (0,41*) |
72 |
Хумана АР |
Хумана, Германия |
1,6 |
3,8 |
7,1 (0,50*) |
69 |
Содержат крахмал |
|||||
НАН Антирефлюкс |
Нестле, Швейцария |
1,2 |
3,4 |
7,8 (2,7**) |
67 |
Сэмпер Лемолак |
Сэмпер АБ, Швеция |
1,3 |
3,5 |
7,4 (0,9***) |
66 |
Энфамил АР |
Мид Джонсон, США |
1,7 |
3,5 |
7,6 (2,1***) |
68 |
† — содержит длинноцепочечные полиненасыщенные жирные кислоты, * — камедь, ** — картофельный крахмал, *** — рисовый крахмал.
При отсутствии положительной клинической динамики ребенка целесообразно перевести на один из специализированных продуктов питания — антирефлюксную молочную смесь (табл. 37), вязкость которой повышается за счет введения в состав загустителей. В качестве таких загустителей используются два вида полисахаридов:
-
неперевариваемые (клейковина бобов рожкового дерева — камедь),
-
перевариваемые (модифицированные крахмалы).
Антирефлюксные смеси обладают хорошей переносимостью и обеспечивают потребность детей во всех основных пищевых веществах и энергии. Их следует применять дифференцированно, учитывая содержание в них загустителей и ориентируясь на состояние здоровья ребенка.
Смеси, содержащие камедь, более показаны при интенсивных срыгиваниях (3–5 баллов). Камедь, входящая в состав антирефлюксных смесей, набухает препятствуя срыгиваниям. Ее содержание колеблется от 0,34 до 0,5 г в 100 мл, при этом максимально допустимое количество составляет 1 г в 100 мл. Температура воды для разведения продуктов («Нутрилак АР», «Нутрилон АР», «Хумана АР»), содержащих инстантную камедь, составляет 40–50 °С, а смесей с натуральной камедью («Фрисовом» 1 и 2) значительно выше — 70–80 °С. Эти продукты одновременно обладают некоторым послабляющим действием, благодаря влиянию неперевариваемых углеводов на моторику кишечника. Антирефлюксные продукты, содержащие камедь, вводятся в рацион ребенка постепенно, в каждое кормление. Объем лечебной смеси подбирается индивидуально до прекращения срыгиваний. Возможно ее добавление в бутылочку со стандартной молочной смесью, которую получает ребенок, но более эффективным является самостоятельное применение в начале кормления.
Продукты, в состав которых в качестве загустителя введен крахмал (рисовый, кукурузный или картофельный) оказывают антирефлюксное действие за счет его набухания в желудке ребенка, тем самым препятствуют срыгиваниям. Эффект от их применения наступает в более отдаленный период по сравнению со смесями, содержащими камедь. Эти смеси показаны детям с менее выраженными срыгиваниями (1–3 балла), как при нормальном стуле, так и при склонности к неустойчивому стулу. Крахмалосодержащие смеси целесообразно рекомендовать для полной замены ранее получаемого молочного продукта.
Несмотря на высокую клиническую эффективность антирефлюксных смесей, они не должны использоваться бесконтрольно, как альтернатива обычным адаптированным молочным формулам. Эти смеси применяются на определенном этапе лечения синдрома срыгиваний, при конкретных показаниях. Продолжительность применения антирефлюксных смесей индивидуальна, иногда достаточно длительная (до 2–3 мес.), и только после достижения стойкого терапевтического эффекта ребенок переводится на адаптированную молочную смесь.
Если рефлюкс является проявлением пищевой непереносимости, то ребенку следует назначить продукт на основе гидролизата молочного белка.
К числу функциональных нарушений ЖКТ у детей грудного возраста относятся также кишечные колики.
КИШЕЧНЫЕ КОЛИКИ
Кишечные колики — это эпизоды беспокойства, болезненного плача, которые занимают не менее 3 часов в день.
Обычно они начинаются в первые недели жизни, достигают кульминации в возрасте 2–3 мес. и постепенно уменьшаются, обычно исчезая в 4 или 5 мес. Вечерние часы — наиболее типичное время для кишечных колик.
Кишечные колики встречаются довольно часто (у 20–48% детей первого года жизни). Это состояние может быть обусловлено такими причинами, как:
-
элементы физиологической незрелости;
-
изменение нормальной моторики кишечника;
-
болезненные спазмы кишечника, вызванные избыточным газообразованием;
-
непереносимость лактозы или аллергия к белкам коровьего молока.
Симптомы кишечных колик — резкий болезненный плач, сопровождающийся покраснением лица, ноги ребенка согнуты и приведены к животу, возникают трудности с отхождением газов и стула. Это вызывает серьезное беспокойство родителей, даже если ребенок выглядит вполне здоровым, нормально растет и развивается и имеет хороший аппетит. При обследовании ребенка патологические нарушения не выявляются. Важно исключить такие заболевания, сопровождающиеся коликами, как частичная лактазная недостаточности или гастроинтестинальная форма пищевой аллергии.
ЛЕЧЕНИЕ
Поскольку существует несколько гипотез возникновения кишечных колик, предлагаются различные способы воздействия для их предотвращения.
Первым шагом в лечении колик обычно является психологическая поддержка и разъяснительная работа: родителям объясняют основные причины кишечных колик, их тенденцию уменьшаться с возрастом.
Диетотерапия колик должна быть дифференцированной, в зависимости от вида вскармливания.
Естественное вскармливание
Из питания матери исключают продукты, повышающие газообразование в кишечнике (сахар и кондитерские изделия, сладкий чай с молоком, виноград, сладкие творожные пасты и сырки, безалкогольные сладкие напитки) и богатые экстрактивными веществами (мясные и рыбные бульоны, лук, чеснок, консервы, маринады, соленья, колбасные изделия), а также продукты с высоким аллергизирующим потенциалом (см. раздел «Пищевая аллергия»). Цельное молоко следует заменить кисломолочными продуктами.
Необходимо исключить перекорм ребенка, особенно при свободном вскармливании.
Искусственное вскармливание
Необходимо подобрать ребенку адекватную современную детскую молочную смесь, соответствующую особенностям его пищеварительной системы, не допускать перекорма. Возможно введение в рацион адаптированных кисломолочных смесей («Агуша кисломолочная» 1 и 2, «НАН Кисломолочный» 1 и 2). При отсутствии эффекта целесообразно использование продуктов, предназначенных для детей с функциональными нарушениями ЖКТ («НАН Комфорт», «Нутрилон Комфорт» 1 и 2, «Фрисовом» 1 и 2 и др.).
Если колики связаны с лактазной недостаточностью, ребенку назначают низколактозные, а при более тяжелых случаях — безлактозные смеси (см. раздел «Лактазная недостаточность»).
При пищевой аллергии могут быть рекомендованы специализированные смеси на основе гидролизатов молочного белка (см. раздел «Пищевая аллергия).
Для медикаментозной терапии кишечных колик используются препараты, содержащие симетикон.
Функциональные запоры (МКБ-10 К59.0)
Под запорами понимают увеличение интервалов между актами дефекации по сравнению с индивидуальной физиологической нормой более 36 часов и/или систематически неполное опорожнение кишечника. Частота стула у детей считается нормальной, если в возрасте от 0 до 4-х мес. происходит от 7 до 1 актов дефекации в сутки, от 4-х мес. до 2-х лет от 3 до 1 опорожнений кишечника. К расстройствам дефекации у младенцев также относятся дисхезия – болезненная дефекация, обусловленная диссинергией мышц дна малого таза, и функциональная задержка стула, для которой характерно увеличение интервалов между актами дефекации, сочетающихся с калом мягкой консистенции, большого диаметра и объема.
Функциональная задержка стула и запоры относятся к числу распространенных нарушений функции кишечника и выявляются у 20–35% детей первого года жизни.
Возникновение запоров чаще всего обусловлено дискинезией толстой кишки (гипо- и гипермоторными расстройствами), нарушением и болезненным актом дефекации — дишезией (спазм сфинктеров прямой кишки, ослабление тонуса гладкой мускулатуры и др.) или сочетанием этих факторов. В редких случаях причиной запоров являются органические нарушения.
В зависимости от этиологии выделяют следующие виды запоров — алиментарный, неврогенный, инфекционный (после перенесенной инфекции), воспалительный, психогенный, токсический, эндокринный (гиперпаратиреоидизм, гипотиреоз, гипофизарные расстройства, сахарный диабет, феохромоцитома, гипоэстрогенемия), медикаментозный (употребление противосудорожных препаратов, антацидов, мочегонных препаратов, препаратов железа, кальция, барбитуратов), вследствие аномалий развития толстой кишки (врожденный мегаколон, подвижная слепая или сигмовидная кишка, болезнь Гиршпрунга и др.).
К факторам риска развития запоров у детей первого года жизни следует отнести раннее искусственное вскармливание, перинатальное поражение ЦНС, недоношенность, морфофункциональную незрелость новорожденного, пищевую непереносимость, дисбиоз кишечника, отягощенную наследственность по заболеваниям пищеварительной системы.
У детей грудного возраста запоры преимущественно обусловлены дискинезией толстой кишки. Другой частой причиной возникновения запоров у детей первого года жизни являются алиментарные нарушения.
ЛЕЧЕНИЕ
Лечение функциональных запоров у детей первого года жизни включает в себя диетотерапию и при необходимости медикаментозное лечение. Основные принципы диетотерапии функциональных запоров у детей первого года жизни:
-
удовлетворение физиологических потребностей ребенка в пищевых веществах и энергии;
-
исключение избыточного потребления белков и жиров, которые могут тормозить моторику кишечника;
-
обогащение рациона пищевыми волокнами (по переносимости);
-
нормализация кишечной микрофлоры (применение пре- и пробиотиков);
-
соблюдение питьевого режима.
Назначение диетотерапии зависит от вида вскармливания. У детей, находящихся на грудном вскармливании, необходимо нормализовать режим питания ребенка для исключения недокорма или перекорма. Учитывая, что состав грудного молока в определенной мере зависит от рациона питания матери, необходимо провести коррекцию пищевого рациона кормящей женщины. В питании матери следует ограничить продукты с высоким содержанием животных жиров, одновременно включая в рацион растительные масла. Отмечена прямая корреляция между возникновением запоров у детей и у их матерей, поэтому в рацион питания кормящей женщины необходимо вводить продукты, стимулирующие моторику кишечника — кисломолочные продукты, продукты с высоким содержанием пищевых волокон (овощи, фрукты, сухофрукты, крупы, хлеб из муки грубого помола и др.), при этом необходимо соблюдать оптимальный питьевой режим.
Запоры у детей первых месяцев жизни могут быть проявлением гастроинтестинальной формы пищевой аллергии. Из рациона питания матери исключаются продукты с высоким аллергическим потенциалом, в частности, цельное коровье молоко, рыба, орехи, которые служат наиболее частой причиной пищевой аллергии у детей первого года жизни (см. раздел «Пищевая аллергия»).
Причиной запоров у детей может быть лактазная недостаточность («запорная» форма), которая характеризуется отсутствием самостоятельного стула при наличии жидких каловых масс (см. раздел «Лактазная недостаточность»).
Функциональные запоры у детей, получающих естественное вскармливание, не являются показанием для перевода ребенка на смешанное или искусственное вскармливание.
При искусственном вскармливании необходимо провести коррекцию режима питания ребенка, уточнить объем получаемого продукта для исключения перекорма. Формула, которую получает ребенок, должна быть максимально адаптирована по содержанию белка и жира. Для детей с запорами следует рекомендовать смеси, в состав которых входят пребиотики- олигосахариды, стимулирующие моторику кишечника. С целью профилактики и лечения запоров может использоваться продукт Нутрилон Комфорт, оказывающий комплексное воздействие на пищеварительную систему: частично гидролизованный белок, олигосахара, а также особенности состава жирового компонента способствуют появлению регулярного стула. Рацион детей может включать кисломолочные продукты (в первые месяцы жизни — адаптированные, поскольку цельный кефир ребенок может получать лишь, начиная с 8-месячного возраста), которые также влияют на моторику кишечника.
У детей с аллергией к БКМ, являющейся причиной запоров, предпочтительнее использовать смеси на основе высоко гидролизованного белка (см. раздел «Пищевая аллергия»).
В случаях недостаточной эффективности указанных мероприятий ребенку необходимо назначить одну из специализированных молочных смесей, предназначенных для вскармливания детей с функциональными запорами. К ним относятся формулы, содержащие лактулозу и клейковину бобов рожкового дерева (с достаточным питьевым режимом).
Лечебное действие смесей, содержащих лактулозу («Сэмпер Бифидус»), заключается в стимуляции перистальтики кишечника и повышении осмотического давления, что приводит к более легкому опорожнению кишечника. Эта смесь может быть рекомендована в полном объеме суточного кормления или в количестве 1/3–1/2 от необходимого объема в каждое кормление, в сочетании с обычной адаптированной молочной смесью и используется до достижения стойкого терапевтического эффекта. После этого вопрос о целесообразности продолжения вскармливания смесью с лактулозой должен решаться индивидуально в зависимости от состояния ребенка.
Смеси, включающие клейковину бобов рожкового дерева (камедь), при функциональных запорах обладают доказанным клиническим эффектом. Камедь рожкового дерева является неперевариваемым полисахаридом. Продукты бактериального гидролиза камеди оказывают стимулирующее влияние на перистальтику кишечника и смягчают стул. Смеси, содержащие камедь, могут быть рекомендованы в количестве 1/3–1/2 от необходимого объема в каждое кормление, в сочетании с обычной адаптированной молочной формулой, до достижения стойкого терапевтического эффекта. В отдельных случаях возможно назначение антирефлюксной смеси в полном объеме.
Введение продуктов и блюд прикорма в рацион детей с запорами должно осуществляться в соответствии с рекомендуемой схемой вскармливания с 4–5 месяцев жизни. Первыми в питание детей с функциональными запорами вводятся продукты, богатые пищевыми волокнами — фруктовое (яблоко, слива, чернослив) или овощное пюре (из кабачка, цветной капусты и др.), а в качестве зернового прикорма используются гречневая, кукурузная, овсяная каши.
При отсутствии эффекта от проводимой диетологической коррекции ее необходимо сочетать с патогенетической терапией, включая спазмолитики, препараты лактулозы полиэтиленгликоля (Форлакс с 6 мес.) и симетикона при наличии метеоризма.
При запорах, связанных с мышечной гипотонией, обусловленной дефицитом карнитина, показано назначение энерготропных препаратов (Элькар, Карнитен, Карнитон).
11. ПИТАНИЕ ПРИ НЕПЕРЕНОСИМОСТИ УГЛЕВОДОВ [12]
Нарушения гидролиза и всасывания углеводов проявляются схожими симптомами так называемой «бродильной», «кислой» или «осмотической» диареи, что объясняется одинаковыми механизмами развития.
Клинические симптомы при непереносимости углеводов
-
частый (8 — 10 раз в сутки и более) жидкий, пенистый стул с большим водяным пятном и кислым запахом;
-
вздутие живота, урчание (метеоризм), боли в животе (колики);
-
наличие углеводов в фекалиях (более 0,25 г% у детей 1-го года жизни);
-
кислая реакция кала (рН менее 5,5);
-
возможно развитие обезвоживания;
-
редко — развитие тяжелой гипотрофии
При отсутствии или недостаточной активности фермента, принимающего участие в гидролизе того или иного углевода, не всосавшиеся и оставшиеся в просвете кишечника дисахариды и/или моносахариды, обладая высокой осмотической активностью, способствуют выходу воды и электролитов в просвет кишечника (осмотический понос), стимулируют моторику верхних отделов ЖКТ, в результате чего избыток углеводов поступает в толстую кишку. В толстой кишке они активно ферментируются кишечной микрофлорой с образованием органических кислот, газообразного водорода, метана, углекислого газа и воды, что вызывает метеоризм, колики, усиленную перистальтику и ускоряет пассаж химуса по кишечнику. При этом рН кишечного содержимого изменяется в кислую сторону. Нарушение нормального химического состава кишечного содержимого может способствовать развитию дисбиоза.
ЛАКТАЗНАЯ НЕДОСТАТОЧНОСТЬ (МКБ-10 Е73)
Лактазная недостаточность (ЛН) — наиболее частая форма дисахаридазной недостаточности, развивающаяся в результате снижения активности фермента лактазафлоризин-гидролаза в энтероцитах слизистой оболочки тонкой кишки. Данный фермент относится к наиболее ранимым энзимам тонкой кишки. Он поверхностно расположен, и концентрация его значительно ниже, чем у других ферментов пристеночного пищеварения. У недоношенных (с 28 по 34 неделю гестации) активность лактазы составляет лишь 30% от ее уровня у доношенных детей. Максимальная активность фермента наблюдается на первом году жизни.
КЛИНИКА
Выраженность клинических симптомов при ЛН обусловлена суммарной степенью снижения активности фермента, количеством поступившей с пищей лактозы, характером кишечной микрофлоры, а также индивидуальной болевой чувствительностью к растяжению кишки газами.
Различают первичную ЛН, связанную с врождённой ферментативной недостаточностью, и вторичную ЛН, которая развивается вследствие повреждения энтероцита при инфекционных, воспалительных, аутоиммунных заболеваниях кишечника, а также непереносимость лактозы при синдроме «короткой кишки».
Наиболее часто педиатры встречаются с гиполактазией у детей первых месяцев жизни. Клинические симптомы (метеоризм, колики, диарея) появляются у ребенка обычно на 3–6 неделе жизни, что, по-видимому, связано с нарастанием объема молока или молочной смеси. В анамнезе у таких детей, как правило, имеются указания на осложненное течение беременности и родов (гипоксия), а у ближайших родственников нередко выявляются симптомы ЛН взрослого типа. У грудных детей с признаками гипоксического поражения ЦНС иногда наблюдается так называемая «запорная» форма лактазной недостаточности, которая характеризуется отсутствием самостоятельного стула при наличии жидких каловых масс и остальных перечисленных выше симптомов. Обычно симптомы у большей части детей купируются к 5–6 месяцам (к моменту введения прикорма) и в дальнейшем не прослеживаются, поэтому такой тип непереносимости лактозы трудно отнести к первичному.
ДИЕТОТЕРАПИЯ
Подход к лечению должен быть дифференцирован в зависимости от характера вскармливания (естественное или искусственное), степени ферментативной недостаточнос ти (алактазия, гиполактазия), генеза ферментопатии (первичного или вторичного) — табл. 38.
| При естественном вскармливании | При искусственном вскармливании |
|---|---|
- максимально полное и длительное сохранение материнского молока в питании ребенка - назначение фермента: Лактаза Энзим или Лактаза Бэби - только при неэффективности (сохранении выраженного б еспокойства, колик, симптомах обезвоживания, недостаточной прибавке массы тела) — возможна частичная замена грудного молока безлактозной молочной смесью на 1/3–2/3 объема каждого кормления |
- частичная или полная замена молочных смесей на низколактозные (после 6 мес.) или безлактозные смеси в зависимости от толерантности к лактозе и характера сопутствующей патологии |
При первичной алактазии новорожденных, которая встречается чрезвычайно редко, ребенок сразу и полностью переводится на вскармливание безлактозной молочной смесью.
При гиполактазии, когда ребенок находится на естественном вскармливании уменьшение количества женского молока нежелательно. Оптимальным вариантом является использование фермента лактазы, например «Лактаза Бэби» (США), в 1 капсуле 700 ед , по 1 капсуле на кормление, при отсутствии эффекта количество фермента увеличивают до 2–5 капсул на прием. Возможно применение фермента «Лактаза Энзим» (США), в 1 капсуле 3450 ед, начиная с 1/4 капсулы на кормление, максимальная доза 5 капсул в сутки. Дозу ферментного препарата смешивают с 20–30 мл сцеженного молока и выпаивают ребенку перед кормлением грудью. Эффективность препаратов возрастает, если сцеженное молоко с лактазой оставить для ферментации на 15–20 минут, а также при обработке лактазой всего объема молока.
При неэффективности использования фермента (что обычно наблюдается при выраженном снижении лактазной активности), прибегают к уменьшению лактозной нагрузки путем замены от 1/3 до 2/3 объема каждого кормления безлактозной молочной смесью (табл. 39), после чего ребенок докармливается женским молоком. Безлактозную смесь вводят в рацион постепенно, в каждое кормление, доводя в течение 3–5 дней до необходимого количества, о чем судят по уменьшению метеоризма, восстановлению нормальной консистенции каловых масс и частоты стула, уменьшению экскреции углеводов с калом, повышению рН кала. Обычно объем безлактозного продукта составляет 30–60 мл на каждое кормление.
Название продукта |
Фирма, страна-производитель |
Ингредиенты, г |
Энергетическая ценность, ккал |
|||
белки |
жиры |
углеводы |
||||
всего |
лактоза |
|||||
Безлактозные смеси |
||||||
Бабушкино лукошко без лактозы |
NUTRIBIO, Франция |
1,69 |
3,38 |
7,56 |
0 |
67,37 |
НАН безлактозный*, ** |
Нестле, Швейцария |
1,4 |
3,3 |
7,8 |
0 |
67 |
Нутрилак безлактозный |
Нутритек, Россия |
1,5 |
3,4 |
7,4 |
0 |
66 |
Нутрилак безлактозный Плюс*** |
Нутритек, Россия |
1,4 |
3,45 |
7,4 |
0 |
66 |
Нутрилон безлактозный*, ** |
Нутриция, Голландия |
1,3 |
3,5 |
7,3 |
0 |
66 |
Энфамил Лактофри |
Мид Джонсон, США |
1,42 |
3,7 |
7,2 |
<0,1 |
68 |
Низколактозные смеси |
||||||
Нутрилак низколактозный |
Нутритек, Россия |
1,6 |
3,5 |
7,3 |
0,9 |
66,3 |
Хумана-ЛП |
Хумана, Германия |
1,8 |
2,0 |
9,2 |
1,1 |
62 |
Хумана-ЛП+СЦТ |
Хумана, Германия |
1,9 |
2,0 |
8,9 |
0,5 |
61 |
Введены: * — нуклеотиды, ** — арахидоновая и докозогексаеновая кислоты , *** — докозогексаеновая кислота
При искусственном вскармливании следует подбирать низколактозную смесь с таким количеством лактозы, которое перенесет пациент, добиваясь купирования клинической симптоматики и снижения экскреции углеводов с калом. С этой целью постепенно детскую молочную смесь частично или полностью вытесняют безлактозным продуктом ребенка, вводя его в каждое кормление. Небольшие количества лактозы, поступающие в толстую кишку, являются естественным пребиотиком, необходимым для правильного формирования микрофлоры. Лактоза является источником галактозы, которая образуется при её расщеплении. Галактоза используется для синтеза галактолипидов, включая цереброзиды, необходимых для миелинизации нервных волокон и формирования центральной нервной системы, а также для синтеза мукополисахаридов (гиалуроновой кислоты), входящих в состав стекловидного тела и синовиальной жидкости. При вторичной лактазной недостаточности у детей старше 6 месяцев могут использоваться низколактозные смеси.
Специализированные смеси на основе изолята соевого белка не содержат лактозы и могут использоваться при лактазной недостаточности; однако их более целесообразно применять при вторичной ЛН, осложняющей аллергию к белкам коровьего молока, у детей второго полугодия жизни.
Первым прикормом (с 4–4,5 мес.) целесообразно назначать безмолочную кашу (рисовую, кукурузную, гречневую), которая при искусственном вскармливании может разводиться безлактозным продуктом. При склонности к запорам, возникающим на фоне лечения, вначале вводится пюре из овощей с негрубой растительной клетчаткой (цветная капуста, кабачок, тыква, морковь) с добавлением растительного масла, а затем — каша. Далее возможно введение фруктового пюре. Мясное пюре назначают с 5,5–6 мес. Фруктовые соки (разбавленные водой 1:1) вводят в питание таких детей позднее, как правило, во втором полугодии жизни. У детей второго полугодия возможно использование молочных продуктов, где содержание лактозы незначительно — творога (отмытого от сыворотки), сливочного масла, 3-суточного кефира или детских йогуртов (с 8 мес.).
При первичной (конституциональной) лактазной недостаточности низколактозная диета назначается пожизненно.
При вторичной гиполактазии симптомы лактазной недостаточности являются транзиторными. Поэтому по достижении ремиссии основного заболевания через 1–3 месяца диету следует постепенно расширять, вводя содержащие лактозу молочные смеси, под контролем клинических симптомов (диарея, метеоризм) и экскреции углеводов с калом.
ВРОЖДЕННАЯ НЕДОСТАТОЧНОСТЬ САХАРАЗЫ-ИЗОМАЛЬТАЗЫ
Врожденная недостаточность сахаразы-изомальтазы является редким заболеванием среди европейцев и наследуется по аутосомно-рецессивному типу. Недостаточность фермента не является жизненно опасным состоянием. Она проявляется впервые при введении в рацион ребенка сахарозы (фруктовые соки, пюре, подслащенная вода или чай), реже — крахмала и декстринов (каши, картофельное пюре) в виде тяжелого «углеводного» поноса с кризами обезвоживания. С возрастом дети нередко приобретают способность переносить все возрастающие объемы декстринов, крахмала и сахарозы без возрастания удельной активности фермента, что связывают с увеличением всасывательной поверхности слизистой оболочки. Нередко у пациентов развивается отвращение к сладким блюдам, фруктам, крахмалистым продуктам, то есть происходит саморегуляция поступления сахарозы в организм ребенка.
Любое повреждение эпителия кишки может привести к вторичной недостаточности данного фермента (инфекционный энтерит, лямблиоз, целиакия), но при этом активность фермента не падает до такого крайне низкого уровня, как при первичной недостаточности.
Основой диетотерапии при этом состоянии является элиминация сахарозы и, иногда, снижение количества крахмала и декстринов в рационе. При первичной (врожденной) недостаточности сахаразы-изомальтазы дети, как правило, хорошо переносят лактозу, при вторичной (постинфекционной) — не переносят, т.е. у них формируется сочетанная дисахаридазная недостаточность. Поэтому при выборе смеси для ребенка с первичной сахаразо-изомальтазной недостаточностью предпочтительно максимально долгое сохранение грудного вскармливания, а при его отсутствии необходимо назначать детскую молочную смесь с лактозным углеводным компонентом.
Дети с недостаточностью сахаразы-изомальтазы не переносят фрукты, ягоды, овощи, соки с высоким содержанием сахарозы (персики, абрикосы, мандарины, апельсины, дыня, репчатый лук, свекла, морковь и др.), а также продукты, богатые крахмалом (каши, картофель, хлеб, кисели и др.). Введение прикорма рекомендуется начинать с пюре из овощей и фруктов, практически не содержащих сахарозы и крахмала (цветная и брюссельская капусты, шпината, щавеля, салата, помидоров, вишни, клюквы, лимона).
Подслащивать пищу можно глюкозой или фруктозой. На втором году жизни обычно удается расширить рацион за счет введения небольшого количества крахмало-содержащих продуктов (овощи, каши, картофель).
При вторичной непереносимости сахарозы продолжительность ее исключения зависит от тяжести основного заболевания и успехов его лечения. Дефицит углеводов рекомендуется компенсировать парентеральным и/или энтеральным введением растворов глюкозы. Период элиминации сахарозы, в отличие от лактозы, менее продолжителен и может ограничиваться 10–15 днями.
Непереносимость крахмала может иметь место у недоношенных и детей первого полугодия жизни, у которых активность панкреатической амилазы физиологически снижена, а также при внешнесекреторной недостаточности поджелудочной железы, поэтому им не показано назначение смесей, включающих крахмал в составе углеводного компонента.
При врожденной (первичной) мальабсорбции глюкозы — галактозы имеется дефект в транспортных системах щеточной каемки энтероцитов, при этом активность дисахаридаз и гидролиз углеводов не нарушены. Эта редкая патология наследуется по аутосомно-рецесссивному типу; проявляется профузным поносом и обезвоживанием после первого кормления новорожденного. Замена молока на безлактозные и безмолочные смеси не дает эффекта. Единственным моносахаридом, способным всасываться в тонкой кишке, является фруктоза. Средством выбора является перевод ребенка на полное парентеральное питание. На фоне парентерального питания кормление начинают с дозированного введения 2,5% раствора фруктозы, концентрацию которой при отсутствии диареи повышают до 7–8%. Далее вводят источник белка (белковый препарат или мясное пюре), жира (растительное масло или жировая эмульсия, начиная с 1–2 капель). В дальнейшем расширение диеты проводят за счет пюре из фруктозо-содержащих овощей. Прогноз заболевания при тотальной мальабсорбции глюкозы-галактозы весьма серьезный. Выжившие дети с частичным дефектом транспортной системы глюкозы-галактозы страдают хронической диареей и отстают в физическом развитии.
Приобретенная непереносимость моносахаридов проявляется тяжелой хронической диареей с задержкой физического развития. Она может сопровождать течение тяжелых кишечных инфекций у детей первых месяцев жизни с неблагоприятным преморбидным фоном, возникать вследствие атрофии ворсинок слизистой оболочки кишки при целиакии, непереносимости белков коровьего молока, белково-калорийной недостаточности. Диарея у ребенка уменьшается, когда он голодает, и возобновляется при увеличении объема перорального кормления. Характерными являются низкий рН и высокая концентрация глюкозы и галактозы в кале. Терапия безлактозными и безмолочными смесями неэффективна.
Приобретенная непереносимость моносахаридов является транзиторным состоянием, однако имеет тотальный характер: не всасываются глюкоза, галактоза, фруктоза, также нарушен гидролиз ди- и полисахаридов. Оральная регидратация стандартными растворами неэффективна из-за содержащейся в них глюкозы. Состояние пациента требует перевода на полное парентеральное питание.
Введение глюкозы перорально начинают осторожно, с 2,5% раствора на фоне стабильного состояния и отсутствия диареи, с постепенным увеличением концентрации раствора. Когда 5% глюкозная смесь хорошо переносится, парентеральное питание можно прекратить. Введение более высоких концентраций глюкозы, крахмала может вновь спровоцировать диарею, что требует повторной разгрузки. При достижении хорошей переносимости глюкозы, декстринов, крахмала постепенно вводят растворы сахарозы, начиная с 3–5% концентрации, фруктовое пюре, соки, разбавленные водой 1:1, и не ранее, чем через 1–2 месяца можно попытаться ввести детскую молочную смесь с умеренно сниженной концентрацией лактозы.
12. ПИТАНИЕ ПРИ ЦЕЛИАКИИ (МКБ-10 К 90.0) [13]
Целиакия (глютеновая энтеропатия) — аутоиммунное заболевание, характеризующееся поражением слизистой оболочки тонкой кишки — Т-клеточно-опосредованной атрофической энтеропатией у генетически предрасположенных индивидуумов под влиянием белков (проламинов) зерна некоторых злаковых культур: глиадина пшеницы, секалина ржи, хордеина ячменя, и, возможно, авенина овса. В медицинской литературе токсичные для больных целиакией белки злаковых принято объединять термином «глютен». Целиакия характеризуется стойкой, пожизненной непереносимостью глютена.
КЛИНИКА
Симптомы типичной целиакии развиваются у детей, как правило, спустя 4–8 недель после введения в рационглютен-содержащих блюд прикорма (манная, пшеничная, овсяная каши, печенье, сухари, сушки, вермишель), обычно в возрасте от 6–8 мес. до 1,5–2 лет, однако они могут впервые проявиться в любом возрасте (табл. 40).
|
Единственным методом лечения заболевания и профилактики осложнений при целиакии является строгая и пожизненная безглютеновая диета. Из рациона исключаются все продукты и блюда, имеющие в составе пшеницу, рожь, ячмень и овес (табл. 41), а также продукты промышленного производства, в которые глютен-содержащие компоненты входят в виде добавок — загустителей, формообразователей, стабилизаторов. Особое внимание следует обращать на фармацевтические препараты, которые могут содержать глютен в качестве наполнителя или в облатке.
| Продукты | Пшеница | Рожь | Ячмень | Овес |
|---|---|---|---|---|
Крупы, каши |
Манная, пшеничная, «Артек», «Полтавская», кускус, булгур, спельта, полба, «4 злака», «7 злаков», и т.п. |
ржаная |
ячменная, перловая, ячневая |
овсяная, «Геркулес», «Спортивная», толокно |
Мука и отруби |
пшеничная мука и отруби |
ржаная мука и отруби |
Ячменная мука |
овсяная мука |
Детские молочные смеси |
«Здоровье» с пшеничной мукой |
Смеси «Малыш», «Малютка 2 плюс» и «Малыш» с овсяным отваром или мукой |
||
Детские каши |
Детские инстантные (быстрорастворимые) каши с пшеничными, манными хлопьями, «смешанные злаки», «4 злака», «7 злаков» и т.п. |
«4 злака», «7 злаков», «смешанные злаки» |
Ячневая, ячменная каша, «4 злака», «7 злаков», «смешанные злаки» |
Все готовые каши с овсяной мукой и хлопьями, «4 злака», «7 злаков», «смешанные злаки» |
Готовое баночное питание |
Консервы для детского питания с мясом, рыбой и овощами и др. с добавками пшеничной муки или манной крупы (см. состав на упаковке) |
Детские мясные, мясоовощные, рыбные, фруктовые консервы с овсяной мукой (см. состав на упаковке) |
||
Хлеб и хлебобулочные изделия; кондитерские изделия |
Хлеб, сушки, сухари, печенье, бублики, баранки, соломка, хлебцы, сдоба, выпечка, торты, блины и пироги и др. |
Ржаной хлеб, лепешки, сухари |
Ячменные лепешки; кондитерские изделия с ячменной патокой, кукурузные хлопья с ячменным солодом (barley malt) |
Овсяное печенье. Хлеб «Геркулес» |
Макаронные изделия |
Макароны, вермишель, рожки,спагетти, лапша, фигурные макаронные изделия |
|||
Мясные, рыбные и молочные полуфабрикаты |
Вареная колбаса, сосиски, полуфабрикаты котлет и др., изделия из рубленого мяса и рыбы, пельмени, вареники, сырники, творожные пасты и сырки, консервы в томатном соусе, подливы к мясным и рыбным блюдам на пшеничной муке, мука и сухари для панировки, кетчупы; бульонные кубики; крабовые палочки |
|||
Напитки |
Хлебный квас |
Пиво; кофейные напитки (суррогаты), растворимые кофе, чаи |
Овсяный кисель |
Нетоксичными злаковыми при целиакии считаются рис, гречиха, кукуруза, пшено. Вопрос о безопасности овса для детей раннего возраста дискутируется, нуждается в дальнейшем изучении. Безопасными являются мука и крахмалы, приготовленные из картофеля, тапиоки, маниоки, батата, бобов, гороха, сои, различных орехов.
Состав рациона больного целиакией зависит от возраста, тяжести состояния и периода заболевания и строится на основании общих принципов: углеводный компонент составляют за счет переносимых круп, картофеля, бобовых, овощей, фруктов и ягод; белковый и жировой — за счет мяса, яиц, рыбы, молочных продуктов, растительного и сливочного масел.
В питании детей и взрослых, больных целиакией рекомендуется использовать специализированные безглютеновые продукты, изготовленные из компонентов, не содержащих глютен (гречневой, рисовой, кукурузной муки, картофельного, кукурузного, рисового крахмала и т.п.), но имитирующих традиционные глютенсодержащие продукты (хлеб, печенье, макаронные изделия). Содержание глютена в таких продуктах, согласно Codex Alimentarius ФАО/ВОЗ, не должно превышать 20 мг/кг.
Для острого периода целиакии в раннем детском возрасте характерны выраженные диспепсические расстройства и нарушения в состоянии питания, вплоть до дистрофии и развития вторичной транзиторной пищевой непереносимости. Наиболее часто это — лактазная недостаточность, что требует исключения лактозосодержащих молочных продуктов практически у всех больных в остром периоде заболевания. У 2/3 детей раннего возраста наблюдается непереносимость белков коровьего молока, что требует временной элиминации всех молочных продуктов из диеты. Нередко наблюдается сенсибилизация к другим пищевым протеинам — рису, банану, белкам куриного яйца и пр. Недостающее количество белка у таких больных компенсируют с помощью продуктов на мясной основе — детских мясных консервов отечественного и зарубежного производства, а также смесей на основе изолята соевого белка.
У детей с резко выраженной дистрофией, высокой степенью поливалентной сенсибилизации важным источником белка могут служить специализированные смеси на основе высоко гидролизованного белка (таблица 33), однако их использование бывает ограниченно вследствие специфических органолептических свойств указанных продуктов (дети со сниженным аппетитом нередко отказываются от них).
При тяжелой гипотрофии нужно учитывать такие факторы, как резкая анорексия, сниженная толерантность к пищевым нагрузкам. При хорошей толерантности детям назначается диета, содержащая до 3 г белка и 120–130 ккал на 1 кг фактической массы тела.
Первыми признаками эффективности лечения в периоде манифестации заболевания целиакии являются улучшение эмоционального тонуса, аппетита и начало прибавки в весе, чего следует ожидать через 1–2 недели лечения. Неустойчивый стул, увеличение живота могут сохраняться довольно продолжительное время.
В период клинико-морфологической ремиссии постепенно расширяют диету за счет включения продуктов, ранее элиминированных по причине транзиторной непереносимости. Молочные продукты вводят, начиная с низколактозных: сливочное масло, творог, отмытый от сыворотки, низколактозные молочные смеси. Постепенно (с учетом переносимости) назначают кисломолочные продукты (кефир, йогурт). Так же осторожно, под контролем индивидуальной переносимости, вводят и другие ранее исключенные продукты, кроме содержащих глютен.
13. ПИТАНИЕ ПРИ МУКОВИСЦИДОЗЕ (МКБ-10 Е-84.0) [14]
Муковисцидоз (кистофиброз поджелудочной железы) — системное наследственное заболевание, которое развивается вследствие мутации гена — муковисцидозного регулятора трансмембранной проводимости (МВТР). Эти мутации приводят к дисфункции протеина (МВТР) апикальной мембраны, который регулирует транспорт ионов хлора и натрия в секреторных эпителиальных клетках.
Клиника
При муковисцидозе (МВ) отмечаются прогрессирующие изменения в легких — от обструкции бронхов вязкой слизью до хронического нагноения с фиброзом с развитием дыхательной недостаточности. Часто наблюдаются кишечные проявления вследствие нарушения функции поджелудочной железы, сопровождающиеся синдромом мальабсорбции и нарушением нутритивного статуса ребенка.
В каждом возрастном периоде у детей преобладают наиболее типичные клинические симптомы, требующие дифференциальной диагностики (табл. 42).
При рождении: • мекониальный илеус; • длительная желтуха в неонатальном периоде |
В грудном возрасте: • рецидивирующие или хронические респираторные симптомы (кашель, одышка); • рецидивирующая или хроническая пневмония; • отставание в физическом развитии (плохая прибавка в весе); • неоформленный, обильный, жирный, зловонный стул, метеоризм; • выпадение прямой кишки; • соленый вкус кожи; • тепловой удар или дегидратация при жаркой погоде (сосудистый коллапс); • хроническая гипоэлектролитемия; • гипопротеинемия/отеки; • данные семейного анамнеза о смерти детей на первом году жизни или наличие сибсов со сходными клиническими проявлениями |
Основной причиной отставания в физическом развитии при МВ является хроническая панкреатическая недостаточность, проявляющаяся в нарушении ассимиляции жира и стеаторее, в меньшей степени — мальдигестии белка и крахмала. В большинстве случаев клинические симптомы поражения ЖКТ появляются раньше, чем первые признаки бронхолегочной патологии. Нарушения стула встречаются уже с первых дней жизни у 47,3%, а к году — у 76,6% больных МВ.
Нарушения хлоридной секреции и повышение слизеобразования ведут к дегидратации кишечного содержимого, что примерно у 10% новорожденных с МВ приводит к развитию мекониального илеуса — закупорке дистальных отделов тонкой кишки густым и вязким меконием, а у детей более старшего возраста — к острой, подострой или хронической обструкции дистальных отделов тонкой и проксимальных отделов толстой кишок клейким секретом слизистой и каловыми массами (синдром дистальной интестинальной обструкции).
Повышенное выделение желудочного сока (имеющееся у 70% больных) на фоне сниженного количества бикарбонатов в секрете поджелудочной железы снижает рН кишечного содержимого. Избыток вязких гликопротеинов и повышенное количество бокаловидных клеток в тонкой кишке уменьшает «доступность» питательных веществ. Отмечается значительное снижение скорости продвижения содержимого по тонкой кишке, наличие непереваренных жиров и аминокислот в ее дистальных отделах, что может приводить к повышенному росту условно патогенных бактерий и усилению мальабсорбции.
Диетотерапия
Важное место в комплексной терапии муковисцидоза отводится диетическому лечению. Сбалансированная диета с использованием современных специализированных продуктов наряду с высокоэффективными панкреатическими ферментами позволяет добиться увеличения калорийности рациона до 120–150% от таковой рекомендуемой здоровым детям, и, таким образом, компенсировать повышенные энерготраты больного муковисцидозом ребенка, обеспечить нормальные темпы роста и развития, сократить частоту инфекционных осложнений.
Потребность в энергии у детей с МВ обычно повышена на 50–90% по сравнению с расчетами на фактический вес, и на 20–50% по сравнению со здоровыми детьми соответствующего возраста и пола. Больные с МВ нуждаются в повышенном количестве белка из-за его потерь вследствие мальабсорбции и эпизодов катаболизма при легочных обострениях (табл. 43).
Возраст |
Белок, г/кг/сут |
Энергия, ккал/кг/сут |
|
минимальная |
максимальная |
||
0–1 год |
3–4 (до 6) |
130 |
200 |
В настоящее время больным МВ с панкреатической недостаточностью удается контролировать стеаторею, сохраняя физиологическую норму жира в рационе больного (40–50% от калорийности рациона) благодаря заместительной терапии современными высокоактивными микросферическими ферментными препаратами с рН-чувствительной оболочкой (Креон). Доза ферментов индивидуальна и подбирается до нормализации стула с учетом лабораторных показателей (исчезновение стеатореи и креатореи в копрограмме, нормализация концентрации триглицеридов в липидограмме кала). Панкреатические ферменты назначаются во время каждого приема пищи, содержащей белки, жиры или крахмал. Детям грудного возраста фермент назначают из расчета 2500–3300 ЕД на 120 мл молока (молочной смеси), что примерно равно 400–800 ЕД липазы на г жира в питании.
Жирорастворимые витамины (А, D, Е, К) и бета-каротин должны добавляться к пище всем больным с панкреатической недостаточностью ежедневно.
Большинство больных МВ нуждаются в дополнительном введении калия, натрия и хлора (подсаливание пищи). Потребность в хлориде натрия возрастает во время обострения легочного процесса, при гипертермии, полифекалии, в условиях жаркого климата, особенно у детей раннего возраста.
Дети первых месяцев жизни должны получать нативное (не пастеризованное) материнское молоко, содержащее термолабильную липазу. Необходимо добавлять панкреатические ферменты в каждое кормление. При невозможности кормления грудью ввиду тяжелого состояния, дети должны получать сцеженное не пастеризованное материнское молоко из бутылочки или через назо-гастральный зонд.
При недостаточной прибавке в весе сцеженное материнское молоко можно обогащать добавлением на каждые 100 мл 5 г сухой смеси на основе гидролизатов белка с СЦТ (табл. 33). При смешанном/искусственном вскармливании предпочтительны смеси, имеющие в качестве жирового компонента среднецепочечные триглицериды и растительные жиры в эмульгированной форме, что позволяет улучшить утилизацию жира и снизить дозу панкреатина. Этим требованиям отвечают отдельные смеси для недоношенных и маловесных детей. Детям второго полугодия жизни и старше может быть рекомендована смесь «Хумана ЛП+СЦТ», содержащая в составе липидного компонента 55% среднецепочечных триглицеридов. При гипотрофии II — III степени назначают смеси на основе гидролизатов белка (табл. 33).
Детям, получающим массивную антибактериальную терапию, повторные курсы антибиотиков, целесообразно ввести адапированную кисломолочную смесь или смесь, обогащенную пробиотиками в количестве до 1/3 суточного объема кормления.
Прикорм обычно вводится в 4–5 мес. Первыми блюдами прикорма служат каши и фруктовые пюре, далее вводят творог, овощное пюре, мясное пюре, желток. Следует использовать высококалорийные продукты прикорма: детские молочные каши промышленного производства с добавлением сахара и сливочного масла, овощные пюре с добавлением растительного масла, мяса (табл. 44). Молоко можно использовать для приготовления блюд с 8–9 месяцев, однако предпочтительно использование специализированной смеси «Хумана ЛП+СЦТ». В эти же сроки можно вводить кисломолочные продукты (кефир, натуральный йогурт), обогащенные живыми бифидо- и лактобактериями. Детям раннего возраста назначают поливитаминные добавки; блюда прикорма подсаливают.
| Продукты и блюда | Возраст, мес |
|---|---|
Фруктовое пюре |
4,5 |
Творог |
4,5 |
Желток |
5* |
Пюре овощное |
4,5–5 |
Масло растительное |
4,5–5 |
Каша |
4 (с добавлением молочной смеси или гидролизата белка) |
Масло сливочное |
4 |
Пюре мясное |
5–5,5 |
Молоко |
8–9 (для приготовления блюд) |
Кефир, |
йогурт 8–9 |
Сухари, хлеб |
7–8 (пшеничный высшего сорта) |
Рыба |
8–9* |
*-при отсутствии аллергических реакций.
14. ДИЕТИЧЕСКАЯ КОРРЕКЦИЯ НАРУШЕНИЙ МИКРОБИОЦЕНОЗА КИШЕЧНИКА [15]
Желудочно-кишечный тракт представляет собой открытую экологическую систему, взаимосвязанными составляющими которой являются структуры макроорганизма, его микрофлора и окружающая среда. Эта система характеризуется единством и способностью к саморегуляции.
Нормальную микрофлору кишечника в настоящее время относят к важнейшим факторам, обеспечивающим здоровье человека. При неблагоприятных воздействиях происходят количественные и качественные изменения состава нормального биоценоза. Однако, благодаря адаптационным возможностям системы «хозяин-микрофлора», эти изменения могут быть кратковременными, они способны исчезать после устранения провоцирующего фактора и обозначаются в настоящее время как дисбактериальные реакции.
Стойкое нарушение микроэкологии пищеварительного тракта, чаще обозначаемое в отечественной практике как дисбактериоз кишечника, представляет собой состояние экосистемы, при котором происходят нарушения функционирования ее составных частей и механизмов их взаимодействия. Однако термин «дисбактериоз кишечника» следует рассматривать как симптомокомплекс, но не как заболевание.
Согласно отраслевому стандарту, под дисбактериозом кишечника понимают клинико-лабораторный синдром, возникающий при ряде заболеваний и клинических ситуаций, характеризующийся: симптомами поражения кишечника, изменением качественного и/или количественного состава нормальной микрофлоры, транслокацией различных видов микрофлоры в несвойственные биотопы, избыточным ростом микрофлоры.
В норме избыточному росту бактерий в тонкой кишке препятствуют: нормальная секреция соляной кислоты (которая предотвращает размножение бактерий в верхних отделах желудочно-кишечного тракта), нормальное поступление желчи в просвет кишки (желчь обладает бактерицидными свойствами), илеоцекальный клапан (предупреждает ретроградное поступление бактерий из толстой в тонкую кишку), пропульсивная моторика тонкой кишки (препятствует застою кишечного содержимого) и особенности анатомического строения толстой кишки (гаустры).
Нарушение любого из этих механизмов неизбежно приводит к изменению состава кишечного биоценоза, следовательно, для эффективной коррекции микроэкологических нарушений в первую очередь необходима терапия, направленная на нормализацию функции органов пищеварения.
В настоящее время существует несколько классификаций дисбактериоза кишечника, основанных на различных клинико-лабораторных критериях. Ниже приведена классификация дисбактериоза, рекомендованная к практическому применению отраслевым стандартом «Протокол ведения больных. Дисбактериоз кишечника» ОСТ 91500.11.0004-2003, согласно которой, выделяют три степени микробиологических нарушений (табл. 45).
Возраст |
Характер нарушений |
|||
Бифидобактерии |
Лактобактерии |
Кишечная палочка |
Условно-патогенные микроорганизмы (УПМ) |
|
I степень микробиологических нарушений |
||||
Дети младше 1 года жизни |
Снижение содержания до 109–108 КОЕ/г |
Снижение содержания до 105–104 КОЕ/г |
Снижение содержания типичных эшерихий до 106–105 КОЕ/г, возможно повышение содержания типичных эшерихий до 109–1010 КОЕ/г |
В пределах нормы |
Дети старше 1 года жизни |
Снижение содержания до 108–107 КОЕ/г |
Снижение содержания до 106–105 КОЕ/г |
Снижение содержания типичных эшерихий до 106–105 КОЕ/г, возможно повышение содержания типичных эшерихий до 109–1010 КОЕ/г |
В пределах нормы |
II степень микробиологических нарушений |
||||
Дети младше 1 года жизни |
Снижение содержания до 108 КОЕ/г и ниже |
Снижение содержания до 104 КОЕ/г и ниже |
Повышение содержания гемолитических и других измененных эшерихий до 105–107 КОЕ/г |
Повышение содержания до 105–107 КОЕ/г или обнаружение ассоциации УПМ в количестве 104–105 КОЕ/г |
Дети старше 1 года жизни |
Снижение содержания до 107 КОЕ/г и ниже |
Снижение содержания до 105 КОЕ/г и ниже |
Повышение содержания гемолитических и других измененных эшерихий до 105–107 КОЕ/г |
Повышение содержания до 105–107 КОЕ/г или обнаружение ассоциации УПМ в количестве 104–105 КОЕ/г |
III степень микробиологических нарушений |
||||
Дети младше 1 года жизни |
Снижение содержания до 108 КОЕ/г и ниже |
Снижение содержания до 104 КОЕ/г и ниже |
Могут обнаруживаться атипичные ешерихии в ассоциациях |
Обнаружение ассоциаций УПМ в количестве 106–107 КОЕ/г и выше |
Дети старше 1 года жизни |
Снижение содержания до 107 КОЕ/г и ниже |
Снижение содержания до 105 КОЕ/г и ниже |
Могут обнаруживаться атипичные ешерихии в ассоциациях |
Обнаружение ассоциаций УПМ в количестве 106–107 КОЕ/г и выше |
Несмотря на то, что дисбиотические сдвиги носят характер вторичных изменений, возникающие в составе микрофлоры изменения могут способствовать затяжному рецидивирующему течению основного заболевания, развитию осложнений.
При длительно существующем дисбалансе кишечной микрофлоры развиваются изменения слизистой оболочки, может возникать повышенная проницаемость кишечного барьера для макромолекул белковой природы, что способствует развитию аллергических реакций, непереносимости определенных пищевых продуктов.
Специфические проявления дисбактериоза пищеварительного тракта отсутствуют. Его симптомами являются неустойчивый стул (понос или запор, чередование запора с поносом) часто со слизью, вздутие живота, урчание. Болевой синдром часто обусловлен повышенным газообразованием. Значительная роль в продукции газа принадлежит микрофлоре. При дисбалансе состава микрофлоры его продукция может увеличиваться. Мелкие пузырьки газа воздействуют на слизистую оболочку, вызывают кишечные колики. Интенсивность боли может снижаться после отхождения газов и дефекации.
Состав микрофлоры толстой кишки вариабелен и может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация и др.). В развитии микроэкологических нарушений в толстой кишке большую роль играют также ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и угнетают рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка). В большинстве случаев эти изменения носят характер временных дисбактериальных реакций, нарушенная экология толстой кишки постепенно восстанавливается самостоятельно и не требует лечения, однако у ослабленных больных (особенно с нарушениями иммунитета) самовосстановления экологии кишки не происходит.
Изменение состава толстокишечной микрофлоры может оказать влияние на кишечный транзит через ряд прямых и непрямых механизмов, включая образование летучих жирных кислот (уксусной, масляной, пропионовой), изменение pH и пр. Время движения перевариваемых масс по толстой кишке в определенной степени зависит и от времени транзита по верхним отделам кишечника. Если последнее возрастает, то для всасывания пищевых веществ в тонкой кишке затрачивается больше времени, что уменьшает объем химуса в толстой кишке. Это сокращение объема питательного субстрата приводит к уменьшению бактериальной биомассы и объёма кала. Далее, уменьшение бактериальной биомассы приводит к сокращению продукции короткоцепочечных жирных кислот и к отвердению стула.
Сокращение вывода токсичных веществ из организма из-за замедленного кишечного транзита вызывает ухудшение общего состояния здоровья. Более того, несбалансированность кишечной микрофлоры, которая возникает при медленном кишечном транзите и запоре, приводит к увеличению продукции вторичных токсических аминов.
ПРЕБИОТИКИ И ПРОБИОТИКИ В СОХРАНЕНИИ И ВОССТАНОВЛЕНИИ МИКРОБНОЙ ЭКОЛОГИИ КИШЕЧНИКА
Обязательным условием эффективности лечебных мероприятий при нарушениях микроэкологии кишечника является устранение причин их возникновения и проведение адекватной терапии основного заболевания. Еще одним залогом успешной терапии микроэкологических расстройств служит коррекция имеющихся нарушений процесса пищеварения (в том числе — нормализация желчеотделения, моторики ЖКТ, при необходимости — ферментотерапия). Устранение микроэкологических изменений включает элиминацию условно-патогенных микроорганизмов препаратами, содержащими нормальную микрофлору, конкурирующую с условно-патогенной, использование пребиотиков и препаратов метаболитного действия с целью создания условий для роста собственной защитной микрофлоры.
В рамках биотической терапии используются преимущественно микроорганизмы, являющиеся симбионтами человека и обозначающиеся термином «пробиотики». Их применение оправданно, поскольку они адаптированы к внутренней среде человека.
Пробиотики — это живые микроорганизмы, которые благоприятно влияют на здоровье человека, нормализуя его кишечную микрофлору.
При разработке продуктов пробиотического действия используются различные виды микроорганизмов, к которым, как и к продуктам, созданным на их основе, предъявляются строгие требования безопасности, функциональной эффективности, технологичности.
Основные требования к безопасности продукта и входящим в него компонентам предусмотрены в документах санитарного законодательства Российской Федерации, а также в международных рекомендациях ФАО/ВОЗ и включают:
-
использование штаммов микроорганизмов, выделенных от человека;
-
отсутствие патогенности, токсичности и побочных реакций;
-
высокие адгезивные свойствах к эпителию слизистой кишечника;
-
стабильность генетического кода.
К показателям функциональной эффективности относятся: выживаемость микроорганизмов и персистенция их в желудочно-кишечном тракте (устойчивость к низким значениям рН, желчным кислотам, антимикробным субстанциям), антогонистическая активность против патогенных микроорганизмов, положительное влияние на организм человека.
При создании продуктов — пробиотиков для детского питания используются в основном бифидобактерии и лактобактерии (табл. 46).
Бифидобактерии |
B.bifidum, B.infantis, B.adolescentis, B.breve, B.longum, B.animalis (B.lactis – BB 12) |
Лактобациллы |
L.acidophilus, L. reuteri, L.casei, L.fermentum, L.plantarum, L.helveticus, L.bulgaricus*, L.rhamnosus (LGG) |
Лактококки и молочно-кислые стрептококки |
L.lactis subsp. lactis, L.lactis subsp cremoris, S.thermophilus |
Симбиотическая кефирная закваска** |
Грибки кефирные, являющиеся природной ассоциацией лактококков, лактобацилл, лейконостоков, дрожжей и уксуснокислых бактерий |
* – используются с 6 месяцев; ** – используется с 8–10 месяцев
Каждый штамм бифидобактерий имеет свои характеристики и диапазон действия. B.bifidum, B.longum и B.infantis превалируют в кишечнике у детей, находящихся на грудном вскармливании. B.adolescentis чаще выделяется у детей на искусственном вскармливании или получающих прикорм, а также у взрослых. В последнее время чаще используются штаммы B.lactis (BВ 12) и B.animalis (actiregularis), обладающие выраженной функциональной активностью и хорошей устойчивостью в желудочно-кишечном тракте. Штамм B.lactis (BВ 12) является в настоящее время наиболее изученным и официально признан «бактерией с абсолютно доказанной безопасностью».
Лактобактерии чаще используются в комбинированных заквасках при создании кисломолочных продуктов. Известно, что лактобактерии L.acidofilus, L. reuteri. L. rhamnosus (LGG), L. casei и L. helveticus обладают хорошей сохранностью в продукте, устойчивостью к внешним воздействиям, высоким пробиотическим эффектом.
Продукты детского питания пробиотического действия могут быть пресными и кисломолочными. К пресным продуктам относятся сухие адаптированные молочные смеси, в состав которой введены пробиотические штаммы бифидо или лактобактерий: B. lactis — в «Нутрилак-Бифи», «НАН 1», «НАН ГА 1»; B.longum — в «НАН 2», «НАН ГА 2»; L. rhamnosus (LGG) — в «НАН 2», «НАН ГА 2»; L. reuteri — в «ХиПП 2 с лактобактериями».
Большинство продуктов-пробиотиков для детского питания являются кисломолочными. Технологические требования предусматривают способность к выживанию выбранного штамма в продукте в ассоциации с заквасочной микрофлорой, быстроту сквашивания, регулируемое кислотообразование, получение гомогенного сгустка. Для сквашивания продуктов используются моновидовые или поливидовые закваски. Кисломолочные смеси обладают двойным функциональным эффектом — за счет пробиотических штаммов и продуцируемой ими молочной кислоты. Основными свойствами кисломолочных продуктов являются влияние на микробиоценоз кишечника, воздействие на секреторную функцию пищеварительных желез и перистальтику кишечника, а также иммуномодулирующий эффект. Они повышают кислотность химуса, ингибируют рост патогенной, гнилостной и газообразующей флоры, стимулируют рост нормальной индигенной флоры, а также улучшают всасывание кальция, фосфора, магния и железа.
Ингибирование роста патогенных микроорганизмов при использовании кисломолочных смесей происходит за счет продукции антимикробных субстанций, конкуренции с патогенной микрофлорой за пищевые вещества, препятствия адгезии патогенных микроорганизмов на рецепторы энтероцитов. Иммуномодулирующий эффект данных продуктов заключается в усилении фагоцитоза, активизации пролиферации лимфоцитов, препятствии деградации секреторного иммуноглобулина А, стимуляции выработки интерферона, лизоцима, пропердина, влиянии на цитокиновую систему, регуляцию выработки интерлейкинов.
Кисломолочные продукты могут быть жидкими и сухими, они также подразделяются на адаптированные и неадаптированные. Жидкие адаптированные кисломолочные смеси «Агуша 1» и «Агуша 2», а также смесь «Адалакт» предназначены для использования в питании детей первого года жизни.
Жидкие адаптированные и частично адаптированные кисломолочные продукты, предназначенные для детей первого года жизни, представлены в табл. 47.
| Название продукта | Используемые штаммы |
|---|---|
Агуша 1 кисломолочная |
Ацидофильная палочка, бифидобактерии |
Агуша 2 кисломолочная |
Ацидофильная палочка, бифидобактерии |
Адалакт |
Ацидофильная палочка, термофильный стрептококк |
Ацидофильная «Малютка» |
Ацидофильная палочка, термофильный стрептококк |
Бифилин |
Бифидобактерии |
К неадаптированным жидким молочным продуктам относятся: «Ацидолакт», «Наринэ», «Биолакт», «Биокефир», «Бифидокефир». Они выпускаются на детских молочных кухнях или в цехах детского питания. Уровень белка в этих продуктах высок и составляет 2,6–2,8 г в 100 мл, а соотношение альбуминовой и казеиновой фракций — 20:80, поэтому их используют в питании детей не ранее 8 месяцев.
Жидкие неадаптированные кисломолочные продукты представлены в табл. 48.
| Название продукта | Используемые штаммы |
|---|---|
Ацидолакт |
Ацидофильная палочка, термофильный стрептококк |
Биолакт |
Ацидофильная палочка |
Наринэ |
Ацидофильная палочка |
Лактобактерин |
Лактобактерии |
Бифидокефир Биокефир Бифидок |
Кефирные грибки, бифидобактерии |
Продукты пробиотического действия нашли широкое применение, как с профилактической, так и с лечебной целью. При их использовании в питании здоровых и больных детей отмечаются хорошие показатели физического развития, улучшение состава кишечной микробиоты и иммунного статуса.
Помимо сухих и жидких молочных смесей пробиотического действия, разработаны рецептуры каш для детского питания, в состав которых введены полезные микроорганизмы. Обоснованием к их включению послужили данные об изменении состава микрофлоры кишечника у детей в период введения прикорма — увеличение количества бактерий — протеолитиков и уменьшение уровня бифидобактерий, что делает ребенка уязвимым к инфекциям, особенно кишечным. Применение продуктов прикорма, обогащенных пробиотиками, позволяет поддержать оптимальный состав кишечной микрофлоры и значительно снизить риск развития кишечных инфекций. Ассортимент таких продуктов постоянно расширяется, и в настоящее время широко применяются каши функционального действия «Помогайка» (Нестле), обогащенные специально подобранными штаммами бифидобактерий.
В последние время большое внимание уделяется обогащению детских молочных смесей пребиотиками — нутриентами, которые используются полезными микроорганизмами кишечника в процессе их роста и оказывают положительное влияние на микробиоценоз.
К пребиотикам относятся олигосахариды грудного молока, синтетические галактоолигосахариды, фруктоолигосахариды, инулин и лактулоза, которые не расщепляются в верхних отделах желудочно-кишечного тракта, но подвергаются бактериальной ферментации в толстой кишке, способствуя селективному росту полезной для организма микрофлоры. Пребиотическими свойствами обладают отдельные неперевариваемые углеводы, входящие в состав пищевых волокон.
Олигосахариды — линейные полимеры глюкозы и других моносахаров, в женском молоке они составляют 12–14% от общего содержания углеводов и представлены преимущественно галактоолигисахаридами. Олигосахариды содержат от 3 до 10 моносахаридных остатков и занимают промежуточное положение между моно- и полисахаридами. Данные пребиотики в совокупности представляют собой третью по количественному содержанию плотную составляющую грудного молока (после лактозы и жира). Максимальная концентрация олигосахаридов определяется в молозиве — 20 г/л, а в зрелом молоке составляет примерно 13 г/л. Состав олигосахаридов грудного молока не зависит от диеты матери, но значительно различается по количеству и качеству у разных матерей. Олигосахариды входят в структуру мембран клеток, являются рецепторами для антител, токсинов, гормонов, патогенов и вирусов.
Бифидодоминантный состав кишечной микрофлоры у детей на грудном вскармливании, во многом обусловленный присутствием в материнском молоке олигосахаридов, имеет ряд положительных эффектов и, прежде всего, выполняет иммуномодулирующую функцию. Известно, что ребенок на естественном вскармливании реже подвержен инфекционным заболеваниям и обладает более высокой резистентностью к кишечным инфекциям.
Бифидогенные свойства пребиотиков легли в основу концепции по обогащению ими детских молочных смесей для искусственного вскармливания. В соответствии с этой концепцией, создана пребиотическая добавка, содержащая 90% короткоцепочечных галактоолигосахаридов и 10% длинноцепочечных фруктоолигосахаридов (с учетом молекулярного спектра олигосахаридов грудного молока). Введение смеси галакто- и фруктоолигосахаридов в состав «заменителей» женского молока — «Нутрилон 1» и «Нутрилон 2», «Нутрилон Комфорт 1» и «Нутрилон Комфорт 2» — стало еще одним шагом, приближающим смесь для искусственного вскармливания к составу женского молока, являющегося «золотым стандартом».
Эти же пребиотики введены в состав и других детских молочных смесей: «Нутрилак 0–6», «Нутрилак 6–12», «Нутрилак 0–12», «Тёма 2», «Фрисолак 1» и «Фрисолак 2», «Фрисопре», «Хумана 2», «Хумана 3», «Хумана Фольгемильх 3», «Хумана ГА 2», «Хумана ГА 3», «Хумана ЛП», «Нестожен 1, 2, 3», «Нестожен Счастливых снов» и др., что подтверждено клиническими исследованиями. Олигосахариды входят в состав молочных каш Нутрилон и Хумана.
В настоящее время разработаны новые адаптированные смеси с синбиотическими свойствами «Агуша GOLD 1» и «Агуша GOLD 2», в состав которых введены как пребиотики галакто- и фруктоолигосахариды, так и пробиотики — бифидобактерии BB12, что позволяет более эффективно формировать кишечную микрофлору ребенка.
Другим углеводом, оказывающим послабляющее действие и влияющим на состояние микробиоценоза кишечника является лактулоза — дисахарид, полученный синтетическим путем. Лактулоза состоит из галактозы и фруктозы, не расщепляется дисахаридазами, в неизмененном виде достигает толстой кишки, где становится субстратом для роста бифидобактерий. Пребиотическое действие лактулозы учитывается при создании детских молочных смесей. Продуктом, в состав которого впервые была введена лактулоза, является Сэмпер-Бифидус.
В настоящее время выпускается «Детское молоко Агуша с лактулозой», которое рекомендуется к использованию в питании детей с функциональными нарушениями желудочно-кишечного тракта.
К пребиотикам относится также инулин — полисахарид, содержащийся в клубнях и корнях цикория, топинамбура, артишоках и др. Инулин нашел достаточно широкое применение в детском питании. Впервые его ввели в состав каши «Кукуруза Низкоаллергенная с инулином» (ДрогаКолинска, Словения). Положительные данные, полученные при ее использовании, послужили основанием к введению инулина и в другие злаковые продукты: «Низкоаллергенная рисовая каша с пребиотиками» и «Овсяная каша с пребиотиками» (Хайнц, США), «Гипоаллергенная каша с пребиотиками», «Каша Тёма рисовая с пребиотиком гипоаллергенная» (Юнимилк, Россия), жидкие молочные кашки «ФрутоНяня с пребиотиками» (ОАО «ПРОГРЕСС», Россия).
Из детских молочных смесей инулин входит в состав отечественных молочных смесей Малютка 1, 2, 3, а также смеси «Фрисолак 3» для питания детей от 1 года до 3 лет.
В состав отдельных каш одновременно введены как пре-, так и пробиотики, что оказывает благоприятное влияние на процессы пищеварения у детей, способствует улучшению или нормализации моторной и эвакуаторной функций кишечника, состава его микрофлоры.
К таким продуктам относится каша «Помогайка» (овес, пшеница с черносливом) Компании Нестле (Швейцария), обогащенная специально подобранными штаммами бифидобактерий и пребиотиками (инулином и/или олигофруктозой).
Таким образом, современные технологии, используемые при производстве детских молочных смесей и каш, позволяют вводить в их состав про- и пребиотики, что придает этим продуктам профилактические и лечебно-профилактические свойства.
15. ПИТАНИЕ ПРИ ОСТРЫХ КИШЕЧНЫХ ИНФЕКЦИЯХ У ДЕТЕЙ (МКБ-10: А04.4; А08.0; А08.3) [16]
Острые кишечные инфекции (ОКИ) — это большая группа инфекционных заболеваний человека с энтеральным (фекально-оральным) механизмом заражения, вызываемых патогенными и условно-патогенными бактериями, вирусами или простейшими.
Клинически ОКИ характеризуются симптомами интоксикации (вялость, сниженный аппетит, лихорадка и др.), часто — развитием синдромов инфекционного токсикоза (токсикоз с эксикозом, нейротоксикоз, гиповолемический или инфекционно-токсический шок и др.) и кишечным (диарейным) синдромом. Особенности клинических проявлений каждой нозологической формы ОКИ обусловлены, главным образом, наличием того или иного набора «пусковых» факторов патогенности у возбудителя инфекции (таких как способность к инвазии, продукция экзо- и эндотоксинов, тропизм их действия и др.).
В настоящее время принято классифицировать кишечные инфекции по этиологическому фактору, подтвержденному на основании лабораторных методов диагностики, что позволяет выявлять нозологические формы ОКИ (шигеллез, сальмонеллез и др.). При отсутствии лабораторного подтверждения диагноз обычно устанавливают по топической локализации патологического процесса (гастрит, энтерит, гастроэнтерит, колит и др.).
Клиническая классификация предусматривает разделение всех ОКИ на группы по «пусковому» механизму и патогенезу развития диареи и инфекционного процесса на «инвазивные», «секреторные», «осмотические» и смешанные.
Определение типа диареи помогает установить возможный этиологический фактор и позволяет дифференцированно подходить к построению терапевтической тактики даже при одной и той же нозологической форме кишечной инфекции (табл. 49).
Тип диареи и топический диагноз |
Возбудители |
Клинические синдромы |
1. Инвазивный (эксудативная диарея):
|
Шигеллы Сальмонеллы Эшерихии (ЭПЭ, ЭИЭ) Иерсинии Кампилобактер Клостридии Клебсиеллы Синегнойная палочка Стафилококк Энтеробактер, протей и другие условнопатогенные микроорганизмы |
|
|
Шигеллы Сальмонеллы Энтероинвазивные эшерихии Некротоксинпродуцирующие штаммы клостридий, кампилобактера, протея, синегнойной палочки |
|
Энтерогеморрагические эшерихии и Шига-токсинпродуцирующие штаммы шигелл, сальмонелл, иерсиний и др. |
Гемолитико-уремический синдром (Гассера) |
|
2. Секреторный («водянистая» диарея без явлений метеоризма):
|
Холерные (Эль-Тор, Бенгал), галофильные, НАГ-вибрионы Энтеротоксигенные штаммы:
|
Синдром дегидратации (токсикоз с эксикозом) |
3. Осмотический («водянистая» диарея с явлениями метеоризма):
|
Ротавирусы, астро-, калици-, торо- и вирусы группы Норфолка, респираторно-кишечные — корона-, адено- и реовирусы |
Синдром дегидратации (токсикоз с эксикозом) |
4. Смешанный тип (инвазивно-секреторный, инвазивно-осмотический) |
Бактериально-бактериальная или вирусно-бактериальная микст-инфекция |
Возможно развитие любого клинического синдрома |
Основные принципы терапии ОКИ в зависимости от типа диареи
Схема лечения кишечных инфекций при «инвазивном» типе диареи представлена в табл. 50, а при осмотических диареях — в табл. 51.
Вид терапии |
Тяжесть заболевания |
||
легкая форма |
среднетяжелая форма |
тяжелая форма |
|
Базисная терапия |
|||
Регидратационная терапия |
При эксикозе 1–2 степени — пероральная регидратация, при эффективности пероральной регидратации, эксикозе 2–3 степени и шоковых состояниях – проводится парентеральнаярегидратационная терапия по общим правилам |
||
Диета с разгрузкой в питании |
на 15–20% |
на 20–30% |
на 30–50% |
Сохраняются грудное молоко, назначаются низко- или безлактозные смеси, адаптированные пресные и кисломолочные смеси, обогащенные защитными факторами (бифидо, лактобактериями, нуклеотидами); в тяжелых случаях – смеси на основе высокогидролизованного белка |
|||
Ферментотерапия |
Назначается с 3–4-го дня болезни при наличии клинических и/или копрологических признаков нарушенного пищеварения. Курс лечения 7–10 дней |
||
Вид терапии |
Тяжесть заболевания |
||
легкая форма |
среднетяжелая форма |
тяжелая форма |
|
Регидратационная терапия |
Компенсация патологических потерь |
При эксикозе 1–2 степени — пероральная, при эксикозе 2–3 степени и неукротимой рвоте — парентеральная регидратация |
|
Диета с разгрузкой в питании |
15–20% |
20–30% |
30–50% |
Сохраняются грудное молоко, назначаются низко- или безлактозные смеси; в тяжелых случаях – смеси на основе высокогидролизованного белка |
|||
Ферментотерапия |
Назначаются ферментные препараты (полиферментные препараты с повышенной амилолитической активностью) с первых дней болезни, если ребенок находится на обычной или низколактозной диете, а также при расширении диеты, при грудном вскармливании – лактаза |
||
Интенсификация регидратационных мероприятий:
|
|||
Регидратационная терапия
Ведущей причиной тяжести ОКИ у детей, приводящей к летальным исходам, является развитие обезвоживания. Поэтому основой рационального лечения больных ОКИ, особенно в дебюте заболевания, является широкое использование оральной регидратации с применением глюкозо-солевых растворов в сочетании с правильным питанием.
Применение данных растворов для оральной регидратации физиологически обосновано: глюкоза обладает свойством усиливать перенос калия и натрия через слизистую тонкой кишки, а это способствует быстрому восстановлению нарушений водно-солевого баланса и нормализации обмена веществ.
ВОЗ рекомендует применять метод оральной регидратации при ОКИ, сопровождающихся так называемой «водянистой диареей» (холера, энтеротоксигенный эшерихиоз и др.), а также при кишечных инфекциях другой этиологии, протекающих с явлениями энтерита, гастроэнтерита и энтероколита (сальмонеллез, ротавирусная инфекция и др.). Оральная регидратация наиболее эффективна, если проводится с первых часов от начала болезни.
ПРЕИМУЩЕСТВА МЕТОДА ПЕРОРАЛЬНОЙ РЕГИДРАТАЦИИ:
-
при эксикозе 1–2 степени с помощью оральной регидратации восстановление концентрации калия, натрия и кислотно-основного состояния происходит быстрее, чем при внутривенном введении регидратационных растворов, хотя нормализация стула может запаздывать на 1–2 дня;
-
использование метода оральной регидратации в больницах позволяет снизить число внутривенных инфузий, что, с одной стороны, снижает стоимость лечения больного и уменьшает сроки его пребывания на койке, а с другой — имеет противоэпидемическое значение (профилактика вирусных гепатитов с парентеральным путем передачи инфекции);
-
простота и доступность метода позволяют применять его уже на догоспитальном этапе лечения больных ОКИ (в поликлинике и даже на дому), а при его использовании в начальном периоде болезни — нередко избежать госпитализации;
-
при высокой эффективности (у 80–95% больных) и при правильном его применении этот метод практически не дает осложнений, в то время как при инфузионной терапии побочные реакции возникают у 16% и более больных.
Показания для проведения оральной регидратации — начальные проявления диареи, умеренное (1–2 степени) обезвоживание, нетяжелое состояние ребенка.
ПОКАЗАНИЯ ДЛЯ ПРОВЕДЕНИЯ ПАРЕНТЕРАЛЬНОЙ РЕГИДРАТАЦИИ:
-
тяжелые формы обезвоживания (2–3 степени) с признаками гиповолемического шока;
-
инфекционно-токсический шок;
-
сочетание эксикоза (любой степени) с тяжелой интоксикацией;
-
олигурия или анурия, не исчезающая в ходе первого этапа регидратации;
-
неукротимая рвота;
-
нарастание объема стула во время проведения оральной регидратации в течение 2-х дней лечения. Эти явления могут быть обусловлены врожденным или приобретенным в период заболевания нарушением всасывания глюкозы (встречается редко).
-
неэффективность оральной регидратации в течение суток.
Для борьбы с обезвоживанием рекомендуется использование препаратов «Регидрон» или «Глюкосолан». Для проведения оральной регидратации можно использовать и другие растворы — оралит, «ORS 200» морковно-рисовый отвар (ХиПП). Однако, при кишечных инфекциях «инвазивного» и, особенно «осмотического» типа, когда в основе диареи лежит гиперосмолярность химуса, предпочтение для проведения оральной регидратации следует отдать гипоосмолярным глюкозо-солевым растворам «Гастролит» с экстрактом ромашки, «Хумана Электролит», «Хумана Электролит с фенхелем».
Расчет объема жидкости для пероральной регидратации
Оральная регидратация при наличии обезвоживания 1–2 степени проводится в два этапа:
I этап: в первые 6 часов проводится ликвидация существующего дефицита массы тела ребенка за счет эксикоза. Объем жидкости, необходимый для этого этапа, равен дефициту массы тела в процентах и рассчитывается по формуле:
мл/час = (М х Р х 10): 6
где, мл/час — объем жидкости, вводимый больному за 1 час
М — фактическая масса тела ребенка в кг
Р — процент острой потери массы тела за счет эксикоза
10 — коэффициент пропорциональности
При определении степени обезвоживания по клиническим симптомам можно пользоваться и ориентировочными показателями об объеме жидкости, необходимом больному за первые 6 часов регидратации, с учетом фактической массы тела и степени обезвоживания (табл. 52).
Масса тела (кг) |
Количество (мл) раствора, необходимого на первые 6 ч при эксикозе |
||
I степень |
II степень |
III степень* |
|
5 |
250 |
400 |
500 |
10 |
500 |
800 |
1000 |
15 |
750 |
1200 |
1500 |
20 |
1000 |
1600 |
2000 |
25 |
1250 |
2000 |
2500 |
30 |
1500 |
2400 |
3000 |
40 |
2000 |
3200 |
3500 |
*— В сочетании с внутривенным введением растворов.
II этап — поддерживающая терапия проводится в зависимости от продолжающихся потерь жидкости и солей со рвотой и испражнениями. Ориентировочный объем раствора для поддерживающей терапии в последующие 18 часов первых суток оральной регидратации равен 80–100 мл/кг массы тела в сутки. Общий объем жидкости в последующие дни (до прекращения жидкого стула) равен объему физиологической потребности ребенка данного возраста + объем патологических потерь со рвотой и стулом, который ориентировочно составляет 10 мл/кг на каждое испражнение.
Диетотерапия при острых кишечных инфекциях
Лечебное питание является постоянным и ведущим компонентом терапии ОКИ на всех этапах болезни. В организации питания больных детей принципиально важен отказ от проведения водно-чайной паузы, поскольку даже при тяжелых формах диареи пищеварительная функция большей части кишечника сохранена. Практиковавшиеся ранее голодные диеты вызывают замедление процессов репарации, приводят к нарушению питания и значительно ослабляют защитные силы организма.
Объем и состав питания зависит от возраста детей, тяжести и выраженности диарейного синдрома, характера предшествующих заболеваний (гипотрофия и др.). Адекватно назначенное питание важно для быстрого восстановления функции кишечника и предотвращения потери массы тела.
Кратность кормлений и количество пищи на один прием определяется возрастом ребенка, тяжестью состояния, наличием и частотой рвоты. Детям перового года жизни, находящимся в тяжелом состоянии назначают 8–10-кратный режим кормления (через 2 часа) с обязательным ночным перерывом в 6 часов. При 10- разовом кормлении ребенок может получать по 10–50 мл пищи за один прием, при 8-кратном (через 2,5 часа) по 60–80 мл. В дальнейшем кратность приемов пищи уменьшают до соответствующей возрасту (табл. 53). Недостающий до физиологической потребности объем питания должен быть возмещен жидкостью энтерально (глюкозо-солевыми растворами — регидроном или глюкосоланом), либо парентерально.
| Объем разового кормления (мл) | Интервал, ч | Количество кормлений | Суточный объем (мл) |
|---|---|---|---|
10–50 |
2 |
10 |
100–500 |
60–80 |
2,5 |
8 |
480–640 |
90–100 |
3 |
7 |
630–700 |
120–160 |
3,5 |
6 |
720–960 |
170–200 |
4 |
5 |
850–1000 |
При нарушении всасывания углеводов и развитии первичного «осмотического» типа диареи (главным образом, при ОКИ вирусной этиологии) или вторичного (при ОКИ «инвазивного» типа) в результате ферментативной (дисахаридазной) недостаточности и бродильного процесса (метеоризма) в случаях искусственного или смешанного вскармливания необходимо ограничить (или в тяжелых случаях полностью исключить) стандартные адаптированные молочные смеси. Ребенку следует назначить низколактозные, безлактозные смеси или продукты, созданные на основе высоко гидролизованного белка. Объем продуктов прикорма уменьшают, исключают цельное коровье молоко, соки. В дальнейшем рекомендуется постепенно вводить кисломолочные смеси (табл. 54).
| Вид продуктов | Перечень продуктов и детских смесей |
|---|---|
Грудное молоко |
|
Адаптированные молочные смеси |
НАН 1 и 2, Нестожен 1 и 2, Нутрилон Комфорт 1 и 2, Фрисолак 1 и 2, Нутрилон 1 и 2, Нутрилак 0–6 и 6–12, Хумана 1 и 2, Энфамил и др. |
Детские молочные смеси обогащенные бифидобактериями |
НАН 1 и 2, НАН Гипоаллергенный 1 и 2, Нутрилак Бифи, Агуша GOLD 1 и 2 |
Кисломолочные смеси |
НАН кисломолочный 1 и 2, Нутрилак кисломлочный, Агуша-1 кисломолочная, Агуша- 2 кисломолочная |
Низколактозные смеси |
Нутрилак низколактозный, Хумана ЛП, Хумана ЛП + СЦТ, безмолочные каши (рисовая, гречневая, яблоко, банан и др.) |
Безлактозные смеси |
НАН безлактозный, Нутрилон безлактозный, Энфамил Лактофри, Нутрилак безлактозный, Нутрилак безлактозный плюс, Бабушкино лукошко без лактозы |
Смеси на основе изолята соевого белка |
Нутрилак Соя, Нутрилон Соя, Фрисосой, Энфамил Соя, Хумана СЛ, каша Хумана СЛ и др. |
Смеси на основе высокогидролизованного белка |
Альфаре, Нутрилак пептиди СЦТ, Нутрилон Пепти ТСЦ, Прегестимил |
Специализированные продукты на основе риса |
Биорисовый отвар, морковно-рисовый отвар «ORS-200» |
Ограничения в диете сохраняются до стойкой нормализации частоты и характера стула.
При наличии неустойчивого характера стула после курса антибиотико- или химиотерапии показано назначение пробиотиков или кисломолочных смесей для коррекции дисбиотических изменений в микрофлоре кишечника. После выписки из стационара ребенок подлежит диспансерному наблюдению и должен соблюдать диету в течение одного месяца.
16. ВСКАРМЛИВАНИЕ НЕДОНОШЕННЫХ ДЕТЕЙ [17]
Организация вскармливания недоношенных детей заключается в адекватном их обеспечении пищевыми веществами и энергией, начиная с первых дней жизни. Своевременно начатое и сбалансированное питание позволяет облегчить течение адаптационного периода и в дальнейшем снизить риск развития ряда заболеваний.
При назначении питания недоношенному ребенку необходимо учитывать следующие положения:
-
выбор способа кормления (энтеральное, парентеральное, комбинированное) определяется тяжестью состояния ребенка, массой тела при рождении и гестационным возрастом;
-
независимо от выбранного способа целесообразно раннее начало питания: в течение первых 2–3 часов после рождения ребенка и не позднее чем через 6–8 часов;
-
при полном парентеральном питании обязательно проведение «минимального» энтерального питания;
-
предпочтительно энтеральное кормление в максимально возможном объеме;
-
рационы питания глубоко недоношенных детей, получающих грудное молоко, по окончании раннего неонатального периода нуждаются в обогащении: с этой целью назначаются «усилители» грудного молока либо проводится смешанное вскармливание с использованием специализированных смесей на основе высоко гидролизованного белка или смесей для недоношенных детей;
-
при искусственном вскармливании используются только специализированные молочные смеси, предназначенные для недоношенных детей, в случае их непереносимости назначаются смеси на основе высоко гидролизованного белка, с последующим переводом на специализированные смеси для недоношенных детей.
Способы вскармливания недоношенных детей
Вскармливание детей, родившихся с массой тела более 2000 г. (срок гестации — 33 недели и более).
Новорожденные дети с массой тела более 2000 г при оценке по шкале Апгар 7 баллов и выше могут быть приложены к груди матери в первые сутки жизни. Обычно в родильном доме или стационаре устанавливается 7–8 разовый режим кормления. Для недоношенных детей свободное вскармливание является неприемлемым в связи с неспособностью таких детей регулировать объем высосанного молока и высокой частотой перинатальной патологии, однако возможно ночное кормление. При грудном вскармливании необходимо внимательно следить за появлением признаков усталости (периорального и периорбитального цианоза, одышки и др.). Их появление является показанием к более редкому прикладыванию к груди или к полному переходу на кормление сцеженным материнским молоком из бутылочки. Усилия врача должны быть направлены на сохранение грудного вскармливания в максимально возможном объеме, учитывая особую биологическую ценность именно материнского нативного молока для незрелого ребенка и важную роль контакта матери с новорожденным во время кормления.
Вскармливание детей, родившихся с массой тела 1500–2000 г. (срок гестации 30 — 33 недели) Детям с массой тела 1500–2000 г, находящимся после рождения в состоянии средней тяжести, проводят пробное кормление из бутылочки, возможно прикладывание ребенка к груди. При неудовлетворительной активности сосания назначается зондовое кормление в полном или частичном объеме (рисунок 5).
Вскармливание детей, родившихся с массой тела менее 1500 г. (срок гестации менее 30 недель)
Практически все недоношенные дети с массой тела менее 1500 г нуждаются в проведении частичного или полного парентерального питания, особенно в первые дни жизни. Чем меньше гестационный возраст новорожденного ребенка, тем длительнее должен быть период парентерального введения питательных веществ.
Энтеральное кормление глубоко недоношенных детей проводится через зонд. Питание через зонд может быть порционным или осуществляться с помощью метода длительной инфузии. При порционном питании в зависимости от переносимости частота кормлений составляет 7–10 раз в сутки. В связи с очень маленьким объемом желудка глубоко недоношенные дети при данном способе кормления получают крайне ограниченное количество нутриентов, особенно в раннем неонатальном периоде. Это диктует необходимость в дополнительном парентеральном введении питательных веществ в значительном объеме.
Длительное зондовое питание позволяет ввести ребенку больше грудного молока или специализированной смеси и тем самым уменьшить объем и длительность парентерального питания. При длительном зондовом введении используются шприцевые инфузионные насосы. Существуют различные схемы проведения длительной инфузии (табл. 55).
| Круглосуточное непрерывное введение с постоянной скоростью | Трехчасовые инфузии с часовыми перерывами | Двухчасовые инфузии с такими же перерывами |
|---|---|---|
Без перерыва |
6–9 ч 10–13 ч 14–17 ч 18–21 ч 22–01 ч 5-часовой ночной перерыв |
6–8 ч 10–12 ч 14–16 ч 18–20 ч 22–24 ч 6-часовой ночнойперерыв |
Во время ночного перерыва при необходимости вводятся раствор глюкозы и раствор Рингера. Первоначальная скорость введения молока может составлять 1,5–3 мл/кг/ч. Постепенно скорость увеличивается, достигая к 6–7 суткам 7–9 мл/кг/ч.
Преимущества проведения длительного зондового кормления по сравнению с порционным введением женского молока или молочных смесей:
-
увеличение объема энтерального питания;
-
достижение полного объема энтерального питания вболее короткие сроки;
-
возможность уменьшения объема и продолжительности парентерального питания;
-
уменьшение застойных явлений в ЖКТ;
-
снижение интенсивности и длительности конъюгационной желтухи;
-
сокращение частоты срыгиваний и дыхательных нарушений, связанных с кормлением.
Если тяжесть состояния ребенка не позволяет осуществить энтеральное кормление, назначается полное парентеральное питание. Но даже в этих случаях обязательно проводится «трофическое» или минимальное энтеральное питание.
Минимальное энтеральное питание назначается не для кормления ребенка, а в целях:
-
становления и поддержания нормального функционирования кишечной стенки (ферментативной активности, моторики);
-
предотвращения атрофии слизистой кишечника;
-
предотвращения застойных явлений в ЖКТ.
При этом предпочтительным является введение материнского молока (молозива), а в случаях его непереносимости — специализированных смесей на основе глубокого гидролиза сывороточных белков, содержащих среднецепочечные триглицериды (СЦТ). Первоначальный объем питания должен составлять не более 5–10 мл/кг/сут при дальнейшем медленном увеличении. Поскольку медленное и продолжительное введение пищи, в отличие от дробного кормления, стимулирует перистальтику кишечника, целесообразно использование инфузионных насосов.
Потребность недоношенных детей в пищевых веществах и энергии
С учетом энерготрат потребность недоношенных детей в энергии составляет 110–135 ккал/кг (ESPGHAN, 2009).
Расчет энтерального питания (при его переносимости) производится только калорийным методом с обязательным учетом энергетической ценности как грудного молока, так и используемых специализированных смесей. Калорийность назначаемого питания преждевременно родившемуся ребенку следует увеличивать постепенно (табл. 56).
Сутки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
10–14 |
Ккал/кг |
25–30 |
35–40 |
50 |
60–65 |
70–80 |
80–90 |
90–100 |
100–120 |
При искусственном вскармливании она не должна превышать 130 ккал/кг/сут. Использование в питании недоношенных детей только женского молока, также как и смешанное вскармливание, предполагает повышение калорийности к 25–30 дню до 140 ккал/кг/сут.
Начиная со 2-го месяца жизни недоношенного ребенка, родившегося массой тела более 1500 г, калорийность рациона снижается ежемесячно на 5 ккал/кг до 115–120 ккал/кг. Снижение калорийности рациона глубоко недоношенных детей (масса тела менее 1500 г) осуществляется в более поздние сроки — после 3-х месячного возраста.
Установлено, что даже глубоко недоношенные дети достаточно хорошо переваривают, всасывают и утилизируют белок, и чем меньше гестационный возраст ребенка, тем выше его потребность в белке. В соответствии с международными рекомендациями (ESPGHAN, 2009) недоношенные дети с массой тела менее 1000 г должны получать 4,0–4,5 г/кг/сут. белка, с массой тела 1000–1800 г — 3,5–4,0 г/сут.
Для недоношенных детей особое значение имеет качество белкового компонента. Преобладание казеина в продуктах питания приводит к низкому усвоению белка и к дисбалансу аминокислот. Поэтому при вскармливании незрелых детей могут использоваться только смеси с преобладанием сывороточной белковой фракции.
Оптимальным считается потребление недоношенными детьми 6–6,5 г/кг жира в сутки (EPSGHAN, 2009 рекомендует от 4,8 до 6,6 г/кг). Для облегчения процесса усвоения жирового компонента специализированных продуктов, предназначенных для вскармливания недоношенных детей, в их состав вводят среднецепочечные триглицериды, которые всасываются в систему воротной вены без предварительного расщепления липазой.
Преждевременно родившиеся дети не способны в достаточной степени синтезировать длинноцепочечные полиненасыщенные жирные кислоты из линолевой и линоленовой кислот, поэтому арахидоновая и докозагексаеновая жирные кислоты вводятся в специализированные продукты для недоношенных детей дополнительно.
Предполагается, что преждевременно родившиеся дети, независимо от вида вскармливания, должны получать около 11,6–13,2 г/кг/сут углеводов (ESPGHAN, 2009). Сниженная активность лактазы, составляющая на 28–34 неделях гестации 30% от ее уровня у зрелого новорожденного, затрудняет расщепление лактозы недоношенными детьми. Для улучшения усвояемости углеводного компонента в специализированных молочных продуктах часть лактозы (15–30%) заменена на декстринмальтозу.
Виды вскармливания недоношенных детей
Вскармливание недоношенных детей женским молоком
Женское молоко после преждевременных родов имеет особый состав, в большей степени соответствующий потребностям недоношенных детей в пищевых веществах и сообразующийся с их возможностями к перевариванию и усвоению. По сравнению с молоком женщин, родивших в срок, в нем содержится больше белка (1,2–1,6 г в 100 мл), особенно на первом месяце лактации, несколько больше жира и натрия и меньше лактозы при одинаковом общем уровне углеводов. Для молока женщин после преждевременных родов характерно и боле высокое содержание ряда защитных факторов, в частности, лизоцима. Женское молоко легко усваивается и хорошо переносится недоношенными детьми.
Несмотря на особый состав, молоко преждевременно родивших женщин может удовлетворить потребности в пищевых веществах лишь недоношенных детей с относительно большой массой тела — более 1800–2000 г, в то время как недоношенные дети с меньшей массой тела после окончания раннего неонатального периода постепенно начинают испытывать дефицит в белке, ряде минеральных веществ (кальции, фосфоре, магнии, натрии, меди, цинке и др.) и витаминов (В2, В6, С, D, Е, К, фолиевой кислоте и др.)
Обогащение рационов недоношенных детей, получающих женское молоко
Сохранить основные преимущества естественного вскармливания и, в то же время, обеспечить высокие потребности недоношенного ребенка в пищевых веществах становится возможным при обогащении женского молока «усилителями» (например, «Пре-Семп», Сэмпер, Швеция, «Breast milk fortifier, Фризленд Фудс, Голландия и др.). Они представляют собой специализированные белково-минеральные или белково-витаминно-минеральные добавки, внесение которых в свежесцеженное или пастеризованное женское молоко позволяет устранить дефицит пищевых веществ.
В питании глубоко недоношенных детей, особенно с массой тела менее 1300 г, целесообразно применять смешанное вскармливание с введением в рацион специализированных смесей на основе высоко гидролизованных белков («гидролизат»). Необходимо использовать продукты, отвечающие следующим требованиям: гидролизованная сывороточная белковая фракция, содержание в жировом компоненте среднецепочечных триглицеридов, отсутствие лактозы. Такой состав имеют «Алфаре» (Нестле, Швейцария), «Нутрилак Пептиди СЦТ» (Нутритек, Россия), «Нутрилон Пепти ТСЦ» (Нутриция, Голландия). Они восполняют недостаточное содержание основных пищевых веществ в грудном молоке, легко усваиваются и хорошо переносятся недоношенными детьми. Целесообразным является введение в рационы питания детей, получающих женское молоко, продуктов на основе гидролизата сывороточных белков в объеме 30%. При недостатке грудного молока или его плохой переносимости количество гидролизованной смеси может быть увеличено. Однако применение смесей на основе гидролизата белка не должно быть длительным; после стабилизации состояния в питании детей необходимо использовать специализированные смеси для недоношенных, наиболее соответствующие потребностям таких детей во всех ингредиентах или «усилители» для грудного молока при достаточном объеме лактации.
При отсутствии возможности использования указанных специализированных добавок и лечебных смесей в питании преждевременно родившихся детей необходимо проведение смешанного вскармливания с назначением специализированных смесей для недоношенных (рис. 6, рис. 7, рис. 8).
*— Предпочтение отдается добавлению к пастеризованному молоку «гидролизата» по сравнению с «усилителем» и специализированными смесями для недоношенных детей.
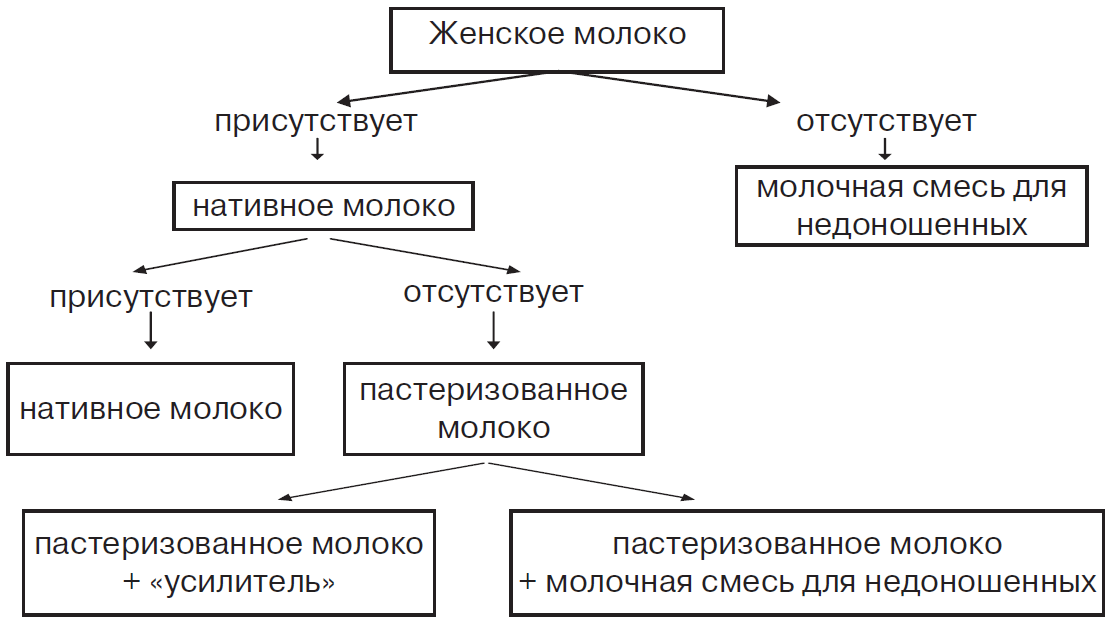
Искусственное вскармливание недоношенных детей
Показаниями к назначению искусственного вскармливания недоношенным детям являются лишь полное отсутствие материнского или донорского молока, а также непереносимость женского молока.
В питании детей, родившихся раньше срока, должны использоваться только специализированные смеси, предназначенные для вскармливания недоношенных детей, питательная ценность которых повышена по сравнению со стандартными адаптированными продуктами. В последние годы в состав таких специализированных смесей вводятся длинноцепочечные полиненасыщенные жирные кислоты, нуклеотиды и олигосахариды (табл. 57).
| Состав | Пре-НАН | Пре-Нутрилак | Пре-Нутрилон с пребиотиками | Хумана — 0-ГА | Фрисо-пре | Энфамил прематуре |
|---|---|---|---|---|---|---|
Энергетическая ценность, ккал |
70/80* |
75 |
80 |
75 |
80 |
68/81* |
Белки, г |
2,0/2,3 |
2,0 |
2,5 |
2,0 |
2,2 |
2,0/2,4 |
Сывороточные белки: казеин |
70:30 |
60:40 |
60:40 |
100:1 |
60:40 |
60:40 |
Таурин, мг |
5,6/6,4 |
5,1 |
5,5 |
4,5 |
5,9 |
4,1/4,9 |
Нуклеотиды |
– |
– |
+ |
– |
+ |
– |
Жиры, г |
3,6/4,2 |
3,9 |
4,4 |
4,0 |
4,3 |
3,4/4,1 |
СЦТ, г |
1,3/1,4 |
1,5 |
0,9 |
1,0 |
– |
0,88/0,96 |
Линолевая, г |
0,6/0,65 |
0,8 |
0,557 |
0,7 |
0,5 |
0,6/0,7 |
a- Линоленовая, г |
0,06/0,07 |
0,08 |
0,079 |
0,06 |
0,05 |
0,07/0,09 |
ДЦЖК |
+ |
– |
+ |
+ |
||
Углеводы, г |
7,5/8,6 |
7,8 |
7,6 |
7,8 |
8,2 |
7,4/7,9 |
Лактоза, г |
4,9/5,6 |
5,0 |
6,2 |
5,5 |
5,9 |
2,96/3,96 |
Сахароза |
– |
– |
– |
– |
0,9 |
– |
Декстрин-мальтоза, г |
2,6/3,0 |
2,8 |
– |
2,3 |
1,4 |
4,4/5,3 |
Олигосахариды, г |
– |
– |
+ |
– |
0,088 |
– |
Минеральные вещества |
||||||
Натрий, мг |
25/29 |
31 |
50 |
33 |
31 |
39/46 |
Калий, мг |
75/86 |
83 |
72 |
89 |
81 |
68/81 |
Хлор, мг |
49/56 |
53 |
66 |
50 |
51 |
58/69 |
Кальций, мг |
87/99 |
85 |
120 |
100 |
100 |
81/97 |
Фосфор, мг |
48/54 |
48 |
66 |
56 |
55 |
44/53 |
Магний, мг |
7,0/8,0 |
8,7 |
8,0 |
8,0 |
7,8 |
6,1/7,3 |
Железо, мг |
1,05/1,20 |
0,9 |
1,4 |
1,1 |
0,78 |
1,2/1,4 |
Йод, мкг |
17,5/20 |
15 |
25 |
19 |
26 |
17/20 |
Медь, мкг |
70/80 |
80 |
80 |
80 |
75 |
71/85 |
Цинк, мг |
0,9/1,0 |
0,8 |
0,9 |
0,8 |
0,7 |
0,68/0,81 |
Марганец, мкг |
5,0/6,0 |
4,5 |
8,0 |
8,0 |
40 |
4,3/5,1 |
Селен, мкг |
1,4/1,4 |
– |
1,9 |
1,5 |
1,6 |
0,74/0,89 |
Витамины |
||||||
Витамин А, мкг |
74/84 |
70 |
180 |
100 |
65 |
104/124 |
Витамин D, мкг |
1,8/2,0 |
2,0 |
3,0 |
1,7 |
2,5 |
1,7/2,0 |
Витамин Е, мг |
1,8/2,0 |
1,5 |
3,0 |
1,0 |
4,1 |
2,9/3,4 |
Витамин К, мкг |
5,6/6,4 |
10,0 |
6,0 |
6,0 |
7,8 |
5,4/6,2 |
Витамин С, мг |
11/13 |
12 |
13 |
11 |
19 |
13,5/16,2 |
Тиамин, мг |
0,05/0,06 |
0,05 |
0,14 |
0,07 |
0,12 |
0,14/0,16 |
Рибофлавин, мг |
0,1/0,12 |
0,10 |
0,2 |
0,13 |
0,18 |
0,2/0,24 |
Ниацин, мг |
0,7/0,80 |
0,6 |
2,4 |
1,7 |
3,0 |
2,7/3,2 |
Витамин В6, мг |
0,05/0,06 |
0,06 |
0,120 |
0,08 |
0,12 |
0,10/0,12 |
Фолиевая кислота, мкг |
49/56 |
40 |
28 |
54 |
48 |
27/32 |
Пантотеновая к-та, мг |
0,3/0,36 |
0,3 |
1,0 |
0,6 |
0,8 |
0,81/0,97 |
Витамин В12, мкг |
0,02/0,24 |
0,25 |
0,18 |
0,20 |
0,28 |
0,17/0,20 |
Биотин, мкг |
1,5/1,8 |
2,6 |
3,0 |
5,0 |
3,3 |
2,7/3,2 |
Холин, мг |
10,5/12,0 |
7,5 |
13,0 |
19,0 |
14 |
12,2/14,6 |
L-карнитин, мг |
1,5/1,7 |
1,4 |
1,8 |
1,2 |
3,0 |
1,4/1,6 |
Инозитол, мг |
4,6/5,2 |
4,0 |
40,0 |
3,2 |
36 |
30/36 |
Осмолярность, мосм/л |
254/290 |
290 |
250 |
300 |
300 |
220/260 |
В случае низкой толерантности недоношенного ребенка к специализированной пре-смеси или выраженной незрелости ребенка используются продукты на основе высоко гидролизованного сывороточного белка, применение которых, однако, не должно быть длительным. Возможно одновременное их использование со специализированными смесями для недоношенных детей с постепенным переходом к использованию последних в полном объеме.
Назначение недоношенным детям молочных продуктов, предназначенных для доношенных детей, приводит к более медленному нарастанию «тощей массы» (прибавка происходит преимущественно за счет жировой ткани), замедлены и темпы скорости роста. Соевые смеси также не должны использоваться в питании недоношенных детей, так как усвоение из них ряда пищевых веществ, особенно минеральных, затруднено, а содержание нутриентов не отвечает потребностям детей данной группы.
Отмена специализированных продуктов и перевод недоношенных детей на стандартные смеси осуществляются постепенно. Длительность применения специализированных смесей для недоношенных детей зависит от количества содержащегося в них белка. Если уровень белка не превышает 2,2 г/100 мл смеси, она может использоваться в полном объеме до достижения недоношенным ребенком массы тела 2500 г; при этом питание рассчитывается калорийным способом — не более 130 ккал/кг. Затем постепенно начинается введение стандартной смеси, но специализированный продукт не вытесняется полностью из рациона питания недоношенного ребенка, а сохраняется в определенном объеме (около 30%) на протяжении нескольких недель или месяцев. При этом обязателен расчет питания не только по калорийности, но и по белку (с постепенным уменьшением его содержания). Длительность комбинированного использования смесей зависит от гестационного возраста ребенка и динамики массо-ростовых показателей. В питании глубоко незрелых детей специализированная смесь в объеме 1–2 кормлений может сохраняться до 6–9месячного возраста.
При более высокой концентрации белка в продукте — 2,3–2,5 г/100 мл — смесь может использоваться в полном объеме до достижения детьми массы тела 1800 г, затем начинается введение стандартного молочного продукта, объём которого подбирается индивидуально. Дальнейшее использование столь концентрированных смесей в полном объеме приводит к избыточному потреблению недоношенными детьми белка с превышением максимально допустимого уровня, равного 4 г/кг.
Длительное использование (до 6 мес. и более) специализированных молочных смесей в небольшом количестве (1/3–1/4 суточного объема) позволяет в наибольшей степени обеспечить глубоко недоношенных детей питательными веществами, увеличить скорость роста и предотвратить развитие остеопении.
В настоящее время разрабатываются и специальные смеси для недоношенных детей, которые необходимо использовать после выписки из стационара. По составу они занимают промежуточное положение между специализированными смесями для недоношенных детей и стандартными молочными смесями. Такие продукты позволят оптимально обеспечить потребности недоношенных детей в этот период.
Введение прикорма недоношенным детям
Продукты прикорма назначаются недоношенным детям начиная с 4–5-месячного возраста. Введение прикорма до 4 месяцев недопустимо в связи с незрелостью как пищеварительной системы, так и обменных процессов. Позднее (с 6 мес.) назначение продуктов прикорма также непозволительно, поскольку запас нутриентов (минеральных веществ и отдельных витаминов) у детей, родившихся раньше срока, резко ограничен. Использование специализированных смесей для недоношенных детей «после выписки», возможно, приведет к более позднему назначению продуктов прикорма.
Введение прикорма осуществляется медленно и постепенно. До достижения детьми 7–8-месячного возраста каждое кормление должно заканчиваться прикладыванием ребенка к груди или использованием молочных смесей. Для маловесных детей, получивших массивную, в том числе антибактериальную, терапию, характерны дисбиотические изменения и нарушения моторики ЖКТ, поэтому у таких детей очередность введения продуктов имеет свои особенности.
Расширение рациона питания начинается за счет введения фруктового пюре, овощного пюре или каши. Предпочтение следует отдавать продуктам промышленного производства для детского питания, так как при их приготовлении используется экологически чистое сырье, они имеют гарантированный состав и соответствующую степень измельчения, обогащены витаминами и минеральными веществами. Введение прикорма начинают с монокомпонентных продуктов. Каши могут вводиться до овощного или фруктового пюре (особенно при наличии у ребенка гипотрофии или железодефицитной анемии), но не ранее 4-месячного возраста. Первыми назначаются безглютеновые (гречневая, рисовая, кукурузная) и безмолочные каши. Они разводятся теми молочными смесями, которые в данное время получает ребенок. Каши не должны содержать каких-либо добавок (фруктов, сахара и др.).
При тенденции к развитию железодефицитной анемии мясо, учитывая хорошее усвоение из него гемового железа, может вводиться с 5,5 месячного возраста. Творог назначается не ранее 6 месяцев: дефицит белка в первом полугодии должен восполняться за счет использования высокобелковых смесей, предназначенных для вскармливания недоношенных детей. Соки, особенно свежеприготовленные, целесообразно вводить позднее, после 6 месяцев, поскольку при раннем назначении они могут провоцировать срыгивания, колики, диарею, аллергические реакции. К тому же их пищевая ценность невелика.
17. ПИТАНИЕ ПРИ ФЕНИЛКЕТОНУРИИ (МКБ-10 Е70.0) [18]
Фенилкетонурия (ФКУ) — наследственная патология, в основе которой лежит нарушение аминокислотного обмена, главным образом фенилаланина и тирозина. ФКУ объединяет несколько генетически гетерогенных форм заболевания, сходных по клиническим признакам: классическая ФКУ, обусловленная дефицитом фенилаланин-4-гидроксилазы (ФКУ I типа) и атипичные (злокачественные) формы, связанные с дефектом птеринового кофактора (ФКУ II и III типа).
По данным неонатального скрининга, который проводится в России с 80-х годов, средняя частота ФКУ среди новорожденных составляет 1:8 000. Чаще всего встречается классическая форма ФКУ, при которой диетотерапия является единственным эффективным методом лечения.
Клинические проявления заболевания
Новорожденный ребенок с классической фенилкетонурией внешне выглядит благополучным, однако, у него уже имеются выраженные нарушения аминокислотного состава крови, при этом уровень фенилаланина в сыворотке крови значительно превышает норму (1–2 мг% или 60–120 мкмоль/л). К фенотипическим особенностям заболевания относятся) гипопигментация кожи, волос, радужной оболочки глаз, своеобразный «мышиный запах» мочи.
Отсутствие лечения приводит к развитию клинических симптомов, манифестация которых происходит в возрасте 2–6 месяцев. Первые признаки болезни неспецифичны и являются следствием проявления вегето-висцеральной лабильности и повышенной нейро-рефлекторной возбудимости. В дальнейшем прогрессируют неустойчивость настроения (вялость, повышенная раздражительность, беспокойство), отсутствие у ребенка интереса к окружающему, срыгивания, нарушения мышечного тонуса (чаще мышечная гипотония), признаки атопического дерматита. Впоследствии формируется задержка моторного и психоречевого развития, нередко отмечается микроцефалия, возможны судороги.
Во втором полугодии жизни у некоторых больных могут развиться эпилептические приступы. Вследствие манифистации клинических симптомов прогрессирует тяжелая умственная отсталость (вплоть до идиотии), что приводит к социальной дезадаптации.
Лечебное питание
До настоящего времени диетотерапия остается единственным эффективным методом лечения классической ФКУ. Основной ее целью является предупреждение развития повреждения ЦНС, умственного дефекта, нарушения физического развития. Поэтому диетотерапию необходимо начать в течение первых недель жизни ребенка.
При организации диетотерапии больным с ФКУ необходимо учитывать:
-
клиническую форму заболевания,
-
уровень фенилаланина в крови,
-
толерантность к фенилаланину пищи,
-
количество общего и натурального белка, получаемого с пищей,
-
возрастные потребности больного ребенка в пищевых веществах и энергии.
Очень важно осуществлять дифференцированный подход к использованию специализированных и натуральных продуктов в лечебном рационе соответственно возрасту ребенка.
Для проведения диетотерапии необходимо наличие специализированных продуктов на основе смесей аминокислот без фенилаланина или гидролизатов белка с низким его содержанием, которые являются основными источниками белка в диете.
На первом году жизни используют лечебные продукты, сбалансированные по всем пищевым веществам, но лишенные фенилаланина или с низким его содержанием. К ним относятся «Афенилак», «ХР Аналог LCP», «МDмил ФКУ 0». Специализированный продукт ПАМ-1 используется со второго полугодия жизни ребенка (табл. 58).
Ингредиенты |
Название. Фирма производитель, страна |
|||
«Афенилак» |
«МDмил ФКУ 0» |
«ХР Аналог LCP» |
«ПАМ-1» * |
|
Нутритек», Россия |
HERO, Испания |
Нутриция, Голландия |
||
Химический состав продуктов |
||||
Белковый эквивалент, г |
15 |
13 |
13 |
75 |
Фенилаланин, мг |
0 |
0 |
0 |
0 |
Жир, г, в .т. ч. линолевая кислота, г a-линоленовая кислота, г |
23 3,85 0,37 |
23 3,6 0,35 |
23 3,8 0,38 |
0 |
Углеводы, г |
55,0 |
59 |
54,0 |
0 |
Минеральные вещества |
+ |
+ |
+ |
+ |
Витамины |
+ |
+ |
+ |
+ |
Биотин мкг |
9,3 |
16 |
26 |
+ |
Холин мг |
49 |
63 |
50 |
+ |
Мио-инозитол, мг |
25 |
26,1 |
100 |
- |
Карнитин, мг |
10,5 |
7,8 |
10 |
50 |
Таурин, мг |
33 |
42 |
30 |
0,5 |
Энергетическая ценность, ккал |
487 |
495 |
475 |
300 |
*— продукт предназначен для больных ФКУ с 5 месяцев до 4 лет.
Количество общего белка в сутки рассчитывается исходя из 2,2–2,9 г/кг массы тела, что соответствует физиологическим нормам потребления белка для детей первого года жизни. Так как фенилаланин является незаменимой аминокислотой, минимальная потребность в ней должна быть удовлетворена для обеспечения нормального роста и развития ребенка, больного ФКУ. Чем меньше ребенок, тем в большем количестве фенилаланина он нуждается, так как (в отличие от взрослых) 40% пищевого фенилаланина у детей расходуется на синтез собственных белков организма. Эквивалентную замену по белку и фенилаланину производят с использованием «порционного» способа расчета: 50 мг фенилаланина приблизительно эквивалентно 1 г белка, что позволяет производить адекватную замену продуктов по белку и фенилаланину.
В течение первого года жизни для детей, больных ФКУ, допустимое количество фенилаланина в сутки составляет от 90 до 35 мг/кг массы тела (табл. 59).
| Возраст детей | Количество фенилаланина (мг/кг массы тела в сутки) |
|---|---|
До 2 мес |
90–60 |
3–6 мес |
55–45 |
7–12 мес |
40–35 |
Специализированные продукты на основе смеси аминокислот вводят в рацион постепенно, в течение 7–10 дней, начальные дозы составляют 1/5–1/10 от их необходимого суточного количества. Одновременно в рационе уменьшают долю белка, содержащегося в натуральных продуктах, а специализированный продукт добавляют в каждый прием пищи. В первые месяцы жизни единственным источником белка за счет естественных продуктов служат сцеженное женское молоко или детские молочные смеси, с минимальным содержанием белка (1,2–1,4 г на 100 мл готовой к употреблению смеси). Сцеженное женское молоко или молочную смесь соединяют с необходимым количеством специализированного продукта, разведенного кипяченой водой или специальной водой для детского питания, при этом общий объем питания соответствует возрасту больного. Питание рекомендовано готовить непосредственно перед каждым кормлением.
Возможны и другие подходы к назначению диеты грудному ребенку. Если уровень фенилаланина в крови очень высок (900–1200 мкмоль/л), то при переводе на лечебную диету разрешается кормить больного в течение 2–3 дней только специализированным продуктом на основе смеси аминокислот без фенилаланина или гидролизата белка с низким его содержанием. Это позволяет более интенсивно снизить уровень фенилаланина крови, лишь после его нормализации в рацион постепенно включают сцеженное женское молоко или детскую молочную смесь.
Назначение прикорма
Как правило, с 4-х месячного возраста рацион больного ФКУ расширяют за счет фруктовых и ягодных соков (яблочный, грушевый, сливовый и др.), с 4,5 месяцев — фруктовое пюре. Прикорм в виде овощного пюре или плодоовощных консервов для детского питания без добавления молока вводят в рацион с 5 месяцев. В 5,5 месяцев назначают 10% кашу из молотого саго, низкобелковой крупки или безмолочные каши промышленного производства на основе кукурузной и рисовой муки, содержащие не более 1,0 г белка в 100 мл готового к употреблению блюда. С 6–7 месяцев в питание вводят муссы, кисели, которые готовятся с использованием амилопектинового набухающего крахмала и фруктового сока. В зависимости от нутритивного статуса ребенка порядок введения блюд прикорма может быть изменен. Особенности состава продуктов прикорма, а также сроки их введения представлены в таблице 60.
| Продукты и блюда | Возраст, мес |
|---|---|
Сок фруктовый |
4 |
Фруктовое пюре |
4,5 |
Овощное пюре |
5 |
Каши низкобелковые |
5,5 |
Кисель, мусс низкобелковые |
6 |
Вермишель низкобелковая |
7 |
Хлеб низкобелковый |
8 |
Каши молочные |
– |
Творог |
– |
Яйцо |
– |
Мясо |
– |
Кефир |
– |
Сухари, печенье |
– |
Растительное масло |
4 |
Сливочное масло |
5 |
Диетическое лечение больных ФКУ необходимо проводить под строгим контролем содержания фенилаланина в сыворотке крови. Для больных ФКУ он должен находиться в средних пределах (3–4 мг% или 180–240 мкмоль/л). Если уровень фенилаланина снижается до 2 мг % и ниже (120 мкмоль/л и ниже) или превышает 8 мг% (480 мкмоль/л), необходима коррекция белка в рационе ребенка.
В России используется следующая схема контроля содержания фенилаланина в крови для детей первого года жизни:
-
до 3-х месяцев — 1 раз в неделю (до получения стабильных результатов) и далее не менее 2-х раз в месяц,
-
от 3-х месяцев до 1 года — не реже 1-го раза в месяц, при необходимости — чаще.
У детей с ФКУ прогноз зависит от времени начала и адекватности диетотерапии. При своевременно начатом лечении классической формы ФКУ прогноз относительно благоприятный. При поздно начатой и неадекватной диетотерапии прогноз существенно ухудшается.
18. ПИТАНИЕ ПРИ ГАЛАКТОЗЕМИИ (МКБ-10 Е74.2) [19]
Галактоземия — наследственное моногенное заболевание, обусловленное снижением или отсутствием активности одного из ферментов, участвующих в метаболизме галактозы: галактозо-1-фосфат-уридилтрансферазы (Г1ФУТ), галактокиназы и уридиндифосфат-глюкоза-4эпимеразы (УДФ-Э). Тип наследования — аутосомнорецессивный.
По данным различных авторов, частота встречаемости галактоземии в популяции колеблется от 1:18000 до 1:187000, а в странах Европы составляет в среднем 1:40000.
Выделяют 3 формы указанного заболевания: «классическая» — галактоземия 1 типа, обусловленная недостаточностью Г1ФУТ, галактоземия II типа вследствие недостаточности фермента галактокиназы, галактоземия III типа развивается из-за недостаточности уридиндифосфат (УДФ)-галактозо-4-эпимеразы.
Наиболее часто встречается «классическая» форма галактоземии. Первые проявления заболевания у новорожденных детей (в виде рвоты, диареи, отсутствия прибавки, а в дальнейшем снижения массы тела и задержки роста) появляются через несколько дней после начала вскармливания грудным молоком или детскими молочными смесями.
При отсутствии своевременной диагностики и патогенетического лечения быстро развивается желтуха с преобладанием в крови фракции неконъюгированного билирубина, которой сопутствуют признаки интоксикации, гипогликемия, анемия, может развиться геморрагический синдром. Постепенно нарастает гепатоспленомегалия с нарушением функции печени, дисфункция почек (почечная недостаточность). Характерны поражения ЦНС в виде диффузной мышечной гипотонии, синдрома угнетения, прогрессирующей задержки психомоторного развития. В неонатальном периоде у больных галактоземией отмечается повышенный риск заболеваемости сепсисом, вызванным кишечной палочкой (Escherichia coli), что нередко приводит к летальному исходу.
В течение первых месяцев жизни у 30% больных формируется катаракта. При своевременно начатом лечении прогноз для жизни больных значительно улучшается.
Диагноз галактоземии устанавливают на основании наличия галактозо-1-фосфата в крови, снижения или отсутствия активности фермента галактозо-1-фосфатуридилтрансферазы в эритроцитах, данных молекулярногенетического исследования.
Выделяют также вариант «классической» галактоземии Дуарте, протекающий практически бессимптомно и не вызывающий угрозы для состояния здоровья ребенка.
Неонатальный скрининг и диагностика
На основании приказа №185 от 22.03.2006 г. Минздравсоцразвития РФ «О массовом обследовании новорожденных детей на наследственные заболевания» массовый неонатальный скрининг на галактоземию проводят на 4 сутки жизни доношенным новорожденным и на 7 сутки жизни — недоношенным детям.
Определение уровня галактозы (total galactose) — галактоза+галактозо-1-фосфат в сыворотке крови проводят с помощью флуоресцентного метода (аппарат Victor). При выявлении уровня общей галактозы 7 мг% и выше проводится повторное исследование (табл. 61).
| Результат | Уровень общей галактозы в сыворотке крови, мг% |
|---|---|
Отрицательный |
<7 |
Пограничный (требуется повторное исследование) |
7–10 |
Положительный |
>10 |
При получении положительных результатов неонатального скрининга назначается диетотерапия, одновременно определяется активность фермента галактозо–1-фосфатуридилтрансферазы и проводится молекулярно-генетическое обследование.
Диетотерапия
Основным методом лечения классической галактоземии является диетотерапия, предусматривающая пожизненное исключение из рациона продуктов, содержащих галактозу и лактозу. Необходимо полностью исключить из рациона больного любой вид молока (в том числе женское, коровье, козье, детские молочные смеси и др.) и все молочные продукты, а также тщательно избегать употребления тех продуктов, куда они могут добавляться (хлеб, выпечка, карамель, сладости, маргарины и т.п). Запрещается также использование низколактозных молока и смесей.
Ряд продуктов растительного происхождения содержит олигосахариды — галактозиды (раффинозу, стахиозу), животного происхождения — нуклеопротеины, которые могут быть потенциальными источниками галактозы (табл. 62).
Галактозиды |
|
Нуклеопротеины |
|
В настоящее время диета с максимально строгим исключением галактозы/лактозы — это единственный способ сократить накопление токсичного компонента — галактозо-1-фосфата в тканях больного с классической галактоземией и галактитола у больных с дефицитом галактокиназы. При галактоземии, обусловленной дефицитом УДФ-галактозо-4-эпимеразы, возможно использование низкогалактозной диеты в соответствии с допустимыми количествами галактозы в рационе под контролем уровня галактозы в сыворотке крови.
При составлении лечебных рационов для детей первого года количество основных пищевых ингредиентов и энергии должно быть приближено к физиологическим нормам.
Для лечения больных галактоземией используются специализированные смеси на основе изолята соевого белка, гидролизата казеина, безлактозные казеинпредоминантные молочные смеси.
Лечебными продуктами первоочередного выбора для больных первого года жизни с галактоземией являются смеси на основе изолята соевого белка. В современных смесях, созданных на основе изолята соевого белка, растительные галактозиды полностью отсутствуют, поэтому им отдается предпочтение при назначении лечебной диеты (табл. 34).
Необходимо помнить, что при использовании соевых смесей в питании грудных детей, возможно появление аллергических реакций на соевый белок и функциональных запоров. В таких случаях целесообразно назначать смеси на основе гидролизата казеина (табл. 63). В зависимости от состояния ребенка возможно сочетанное применение соевой смеси и смеси на основе гидролизата казеина в соотношении 1:1.
Название смеси |
Фирма-производитель, страна |
Ингредиенты, г |
Энергетическая ценность, ккал |
||
белки |
жиры |
углеводы |
|||
Прегестимил |
Мид Джонсон, США |
1,9 |
3,8 растительные + СЦТ |
6,9 полимеры глюкозы модифицир. кукурузный крахмал |
67,6 |
Нутрамиген |
Мид Джонсон, США |
1,9 |
3,7 растительные |
7,5 полимеры глюкозы модифицир. кукурузный крахмал |
68 |
Фрисопеп АС |
Фризленд Фудс, Голландия |
1,5 |
3,5 растительные |
7,2 полимеры глюкозы |
67 |
Безлактозные молочные смеси с преобладанием сывороточных белков не рекомендуется использовать в диетотерапии у детей с галактоземией грудного возраста, так как могут содержать следовые количества галактозы, поэтому следует применять только казеинпредоминантные безлактозные молочные смеси (табл. 64).
Название смеси |
Фирма-производитель, страна |
Ингредиенты, г |
Энергетическая ценность, ккал |
||
белки |
жиры |
углеводы |
|||
Энфамил Лактофри |
Мид Джонсон, США |
1,42 (80:20)* |
3,7 |
7,2 |
68 |
Нутрилак безлактозный Плюс |
Нутритек Россия |
1,4 (50:50) |
3,45** |
7,4 |
66 |
* — Соотношение казеина и сывороточных белков (%); ** — Содержит докозогексаеновую кислоту.
Специализированные смеси вводят в рацион больного с галактоземией постепенно, в течение 5–7 дней, начальные дозы составляют 1/5–1/10 часть от необходимого суточного количества, одновременно уменьшают долю женского молока или детской молочной смеси до полного их исключения.
Особенности назначения прикорма при галактоземии
С 4-х месячного возраста рацион больного с галактоземией расширяют за счет фруктовых и ягодных соков (яблочный, грушевый, сливовый и др.), начиная с 5–10 капель, постепенно увеличивая объем до 30–50 мл в сутки, к концу года — до 100 мл. С 4,5 месяцев вводят фруктовое пюре, количество которого увеличивают так же, как при введении сока.
Первый прикорм в виде овощного пюре из натуральных овощей или плодоовощных консервов для детского питания без добавления молока (и не имеющих в составе бобовых) назначают с 5 месяцев.
В 5,5 месяцев вводят второй прикорм — безмолочные каши промышленного производства на основе кукурузной, рисовой или гречневой муки. Для разведения каш необходимо использовать ту специализированную смесь, которую получает ребенок.
Мясной прикорм вводят в питание с 6 месяцев. Преимущество отдают специализированным детским мясным консервам промышленного выпуска, не содержащим молока и его производных (кролик, цыпленок, говядина, индейка и др.).
Особенности состава продуктов и блюд прикорма и сроки их введения при галактоземии отражены в табл. 65.
| Продукты и блюда | Возраст, мес |
|---|---|
Сок фруктовый |
4 |
Фруктовое пюре |
4,5 |
Овощное пюре |
5 |
Каши молочные |
– |
Каши безмолочные |
5–5,5 |
Творог |
– |
Яйцо (желток)* |
После 12 мес |
Мясное пюре |
6 |
Рыба |
8 |
Кефир и другие кисломолочные продукты |
– |
Сухари, печенье (обычные) |
– |
Сухари, печенье, (не содержащие компонентов молока) |
7 |
Растительное масло |
4,5 |
Сливочное масло |
– |
* — Желток вводится после 1 года не чаще 2–3 раз в неделю.
При составлении рациона детям первого года жизни желательно учитывать содержание галактозы в продуктах прикорма.
При выборе продуктов прикорма промышленного производства ориентируются на содержание в них галактозы (при наличии маркировки на этикетке): безопасными считаются продукты с содержанием в них галактозы не более 5 мг на 100 г продукта. При наличии галактозы в количестве от 5 до 20 мг на 100 г — продукт применяется с осторожностью под контролем содержания общей галактозы в сыворотке крови, при содержании галактозы более 20 мг в 100 г — продукт не используется (табл. 66).
| Продукты | Содержание галактозы (мг/100 г продукта) |
|---|---|
Свободное использование |
Менее 5 |
Ограниченное использование |
5–20 |
Не используются |
Более 20 |
При лечении галактоземии следует обращать внимание на содержание лактозы в лекарственных средствах, так как она нередко используется в качестве вспомогательного вещества, например, в процессе приготовления гранул гомеопатических препаратов. Нельзя также пользоваться настойками и спиртовыми лекарственными формами, которые замедляют элиминацию галактозы из печени.
Контроль адекватности проводимой терапии осуществляют путем определения содержания общей галактозы (галактоза+галактозо-1-фосфат) в сыворотке крови 1 раз в 3 месяца. В течение первых месяцев жизни ребенка на фоне безлактозной диеты уровень общей галактозы может быть выше, чем у здоровых детей, однако, он не должен превышать 3–5 мг%.
Приложение A: СРЕДНЕСУТОЧНЫЕ НОРМЫ
Среднесуточные нормы физиологических потребностей в пищевых веществах и энергии для детей раннего возраста*
| Возраст | Энергия, ккал | Белки, г | Жиры, г | Углеводы, г |
|---|---|---|---|---|
0–3 мес ** |
115 |
2,2 |
6,5 |
13 |
4–6 мес** |
115 |
2,6 |
6,0 |
13 |
7–12 мес** |
110 |
2,9 |
5,5 |
13 |
* — Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации. Утверждены 18 декабря 2008 г. (МР 2.3.1.2432-08).
** — Потребности детей первого года жизни в энергии, белке, жире, углеводах даны в расчете г/кг массы тела.
Среднесуточные нормы физиологических потребностей в минеральных веществах для детей раннего возраста
| Возраст | Ca, мг | P, мг | Mg, мг | Fe, мг | Zn, мг | I, мг |
|---|---|---|---|---|---|---|
0–3 мес |
400 |
300 |
55 |
4 |
3 |
0,06 |
4–6 мес |
500 |
400 |
60 |
7 |
3 |
0,06 |
7–12 мес |
600 |
500 |
70 |
10 |
4 |
0,06 |
Среднесуточные нормы физиологических потребностей в витаминах для детей раннего возраста
| Возраст | C, мг | А, мкг | Е, мг | Д, мкг | В1, мг | В2, мг | В6, мг | РР, мг | фолаты, мкг | В12, мкг |
|---|---|---|---|---|---|---|---|---|---|---|
0–3 мес. |
30 |
400 |
3 |
10 |
0,3 |
0,4 |
0,4 |
5 |
50 |
0,3 |
4–6 мес. |
35 |
400 |
3 |
10 |
0,4 |
0,5 |
0,5 |
6 |
50 |
0,4 |
7–12 мес. |
40 |
400 |
4 |
10 |
0,5 |
0,6 |
0,6 |
7 |
60 |
0,5 |
Приложение B: СПОСОБЫ РАСЧЕТА ОБЪЕМА ПИТАНИЯ, НЕОБХОДИМОГО ДЕТЯМ НА СМЕШАННОМ ИЛИ ИСКУССТВЕННОМ ВСКАРМЛИВАНИИ
В первые 7–10 дней жизни ребенка его потребность в женском молоке или детской молочной смеси быстро возрастает. Для приблизительного расчета суточного объема питания можно пользоваться формулой Зайцевой.
Объем молока за сутки (мл) = 2% от массы тела (г) при рождении Х n,
где n — число дней жизни ребенка.
Для определения количества детской молочной смеси, необходимого на одно кормление, следует разделить суточный объем на число кормлений. Разовый объем молока можно также подсчитать, умножив число дней жизни ребенка на 10.
После 7–10-го дня жизни ребенка при подсчете объема питания используют калорийный, объемный способы или формулу Шкарина.
При расчете питания калорийным способом учитываются энергетические потребности детей, которые в первом полугодии составляют 115 ккал/кг, а во втором полугодии — 110 ккал/кг. Зная массу тела ребенка и приблизительную калорийность детской молочной смеси (680 ккал в 1 л), можно рассчитать его необходимый суточный объем. Так, ребенку в возрасте 2 мес с массой тела 4600 г требуется 115 Х 4,6 = 529 ккал в сутки. Объем женского молока = (529 Х 1000): 680 = 780 мл.
Объемный метод заключается в определении суточного объема питания в зависимости от массы тела и возраста ребенка.
| Возраст | Суточный объем молока |
|---|---|
10 дней — 2 мес |
1/5 массы тела |
2–4 мес |
1/6 массы тела |
4–6 мес |
1/7 массы тела |
6–9 мес |
1/8 массы тела |
Использование формулы Шкарина предполагает, что ребенок в возрасте 8 нед (2 мес) должен получать 800 мл молока в сутки.
На каждую неделю, недостающую до 8 нед — на 50 мл меньше смеси: 800–50 Х (8–n),
где n — число недель жизни ребенка.
На каждый месяц после 2 мес — на 50 мл смеси больше: 800 + 50 Х (n-2),
где n — число месяцев жизни ребенка.
При расчете питания любым способом необходимо помнить, что его суточный объем питания у детей первого полугодия жизни не должен превышать 1000 мл, во втором полугодии — 1000–1100 мл.