Ответственные исполнители:
— Демихов Валерий Григорьевич — д-р мед. наук, проф., директор Научно- клинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России.
— Морщакова Елена Федоровна — д-р мед. наук, заместитель директора по науке Научно-клинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России.
— Лунякова Мария Анатольевна — канд. мед. наук., зав. отделом гематологии и онкологии Научно-клинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России.
— Инякова Наталья Викторовна — канд. мед. наук, научный сотрудник Научно- клинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России.
Рецензирование, обсуждение содержания рекомендации проводилось на сайте НОДГО, совещаниях, съездах педиатров, гематологов России.
Диагностика и лечение анемии хронических болезней
МКБ-10: рубрикой D63.8
1. АНЕМИЯ ХРОНИЧЕСКИХ БОЛЕЗНЕЙ
Син.: анемия воспаления
Код по МКБ-1 D63.8
Анемия хронических болезней (АХБ) является второй по распространенности после ЖДА и наблюдается у пациентов с острой или хронической активацией иммунной системы вследствие различных как инфекционных, так и неинфекционных заболеваний (см. рисунок).
Наиболее частые состояния, которые могут приводить к развитию АХБ, представлены в таблице (см. таблицу).
В настоящее время считается, что образование гепцидина – ключевой механизм развития АХБ. Являясь гормоном, секретируемым гепатоцитами в условиях воспаления, гепцидин блокирует всасывания железа в кишечнике и реутилизацию железа из депо (депонирование железа в клетках моноцитарно-макрофагальной системы), тем самым снижая концентрацию железа в плазме крови, что способствует развитию железодефицитного эритропоэза. Другим важным фактором развития АХБ является неадекватно низкая продукция ЭПО вследствие избыточной продукции провоспалительных цитокинов. Таким образом, ведущую роль в развитии АХБ играет комплекс факторов, основными из которых являются нарушение гомеостаза железа вследствие повышенной продукции гепцидина и нарушение эритропоэза в виде неадекватно низкой продукции ЭПО степени анемии, что является патогенетическим обоснованием терапевтического применения при них эритропоэзстимулирующих препаратов (ЭСП).
АХБ развивается не только при хронических, но и острых воспалительных заболеваниях. Снижение уровня Hb можно обнаружить уже менее, чем через 2 недели от начала заболевания. Обычно это умеренная, микроцитарная анемия с уровнем Hb 90-130 г/л и гематокритом 30-40%. Лишь у 20% пациентов гематокрит может снижаться меньше 25%. При хроническом течении анемии, она становится более гипохромной с более выраженным воспалительным компонентом в ее этиологии. При острой инфекции, когда анемия развивается быстро, она часто нормохромная.
| Заболевания, ассоциируемые с анемией хронических болезней | Предположительная распространенность анемии при данном заболевании (%) |
|---|---|
Инфекции (острые и хронические)
|
18 – 95 |
Рак
|
30 – 77 |
Аутоиммунные реакции
|
8 – 71 |
Хроническая реакция трансплантат против хозяина после органной трансплантации |
8 – 70 |
Хронические заболевания почек |
23 – 50 |
1.1. Особенности диагностики анемии хронических болезней
Принципиальное различие между ЖДА и АХБ заключается в том, что ЖДА имеет отношение к абсолютному дефициту железа, тогда как патофизиология АХБ является мультифакторной. С высокой долей вероятности об АХБ следует думать, если анемия развилась на фоне тяжелых заболеваний. АХБ необходимо также исключить в случаях, когда перо-ральная ферротерапия в течение 4 нед не привела к повышению НЬ >10 г/л. С этой целью проводится определение биохимических показателей обмена железа с расчетом коэффициента НТЖ и концентрации сывороточного ферритина СФ (см. клинические рекомендации по ЖДА, дифференциальная диагностика). Следует учитывать, что уровень СФ повышается в условиях воспаления (острые и хронические инфекции, болезни печени, аутоиммунные и онкологические заболевания), что может маскировать наличие дефицита железа (ДЖ). Поэтому при повышенном уровне СРБ (>10 мкг/л) ДЖ констатируется при СФ <50 мкг/л.
Для выявления ДЖ в случаях часто встречающегося сочетания ЖДА и АХБ, при котором ФС, как правило, нормальный или повышен, в клинической практике рекомендуется использование коэффициента НТЖ. У пациентов с АХБ в сочетании с ДЖ НТЖ меньше возрастного уровня, представленного в таблице см. таблицу.
Насыщение трансферрина железом, % (НТЖ) = (железо сыворотки (ЖС) * : общую железосвязывающую способность сыворотки * (ОЖСС)) × 100% |
– 1–2 года - < 9% – 3–5 лет - < 13% – 6–15 лет - < 14% – старше 15 лет- <16% |
* не имеют самостоятельного значения для диагностики ДЖ
Нормальный уровень сывороточного трансферринового рецептора 1 (сТФР) и высокая концентрация гепцидина, характерные для АХБ, вероятно, имеют высокую диагностическую ценность. Однако их применение в клинической практике ограничивается отсутствием доступных коммерческих тест-систем и стандартизации в педиатрической практике.
1.2. Лечение АХБ
Адекватное лечение основного заболевания – наиболее эффективный способ лечения АХБ. Однако лечение АХБ необходимо при всех хронических заболеваниях трудно поддающихся терапии (системные заболевания соединительной ткани, хронические воспалительные заболевания кишечника, ВИЧ-инфекция и др.), поскольку анемия значительно ухудшает прогноз и исходы этих заболеваний и является независимым фактором риска повышенной летальности. Поскольку гепцидин блокирует всасывания железа в кишечнике, лечение АХБ пероральными препаратами железа не эффективно. Частичный эффект от пероральной ферротерапии может наблюдаться у пациентов с АХБ, развившейся на фоне ДЖ. Внутривенная ферротерапия с патогенетической точки зрения более целесообразна при АХБ, однако если она используется в виде монотерапии (только в случаях доказанного при АХБ ДЖ по низкому уровню НТЖ или ФС) следует ожидать высокого уровня резистентности (около 50%) к терапии. Это связано с неадекватно низкой продукцией ЭПО степени тяжести анемии, характерной для АХБ. Поэтому наиболее эффективной схемой лечения АХБ является комбинированное использование ЭСП и внутривенных препаратов железа. Использование пероральных препаратов железа вместо внутривенной ферротерапии допустимо, но может снижать ответ на рчЭПО терапию.
В настоящее время самый большой опыт применения рч ЭПО у детей и подростков имеется у пациентов с хронической почечной недостаточностью (см. соответствующие клинические рекомендации). В литературе доступны немногочисленные публикации о эффективности рч ЭПО в сочетании с препаратами железа при АХБ у детей.
С практической точки зрения уровень сывороточного ЭПО (с-ЭПО), определяемый у пациента с анемией, не может просто сравниваться с нормальным значением ЭПО. Продукция ЭПО почками увеличивается обратно пропорционально степени гипоксии (снижения концентрации Hb). Поэтому уровень с-ЭПО следует оценивать относительно степени тяжести анемии. В каждой лаборатории рекомендуется на основании анализа данных обследования популяции пациентов с анемией (чаще с ЖДА) рассчитать уравнение регрессии Hb-ЭПО, которое будет моделью адекватности продукции ЭПО степени тяжести анемии.
Для врача-клинициста важно все анемии разделить на две большие группы: I – анемии с адекватной продукцией ЭПО и II – анемии с неадекватно низкой продукцией ЭПО степени тяжести анемии.
Оценку адекватности продукции ЭПО проводят на основании определения отношения логарифма, определяемого (О) уровня ЭПО (в исследуемой сыворотке) к логарифму предполагаемого (П) уровня ЭПО (в контрольной сыворотке пациента с ЖДА с тем же уровнем Hb) – коэффициент О/П (log ЭПО). Продукцию ЭПО считают неадекватно низкой степени анемии при О/П (log ЭПО) < 0,8.
При анемии с адекватной продукцией ЭПО выявляется высокая степень обратной зависимости уровня Hb от концентрации сывороточного ЭПО. То есть, чем ниже уровень Hb, тем выше концентрация ЭПО в сыворотке крови. Моделью адекватной продукции ЭПО степени анемии является ЖДА (верхняя прямая см.рисунок). При анемиях с неадекватно низкой продукцией ЭПО обратная зависимость уровня Hb от концентрации ЭПО низкая (нижняя прямая см.рисунок). Уровень эндогенного ЭПО при этом виде анемии, если и повышается, то незначительно, и не соответствует степени снижения уровня Hb (неадекватно низкая степени анемии продукция ЭПО). В группу ЭДА относятся: анемия при хронической почечной недостаточности, АХБ, ранняя анемия недоношенных, анемия при злокачественных новообразованиях, анемия при хронической сердечной недостаточности, анемия беременных.
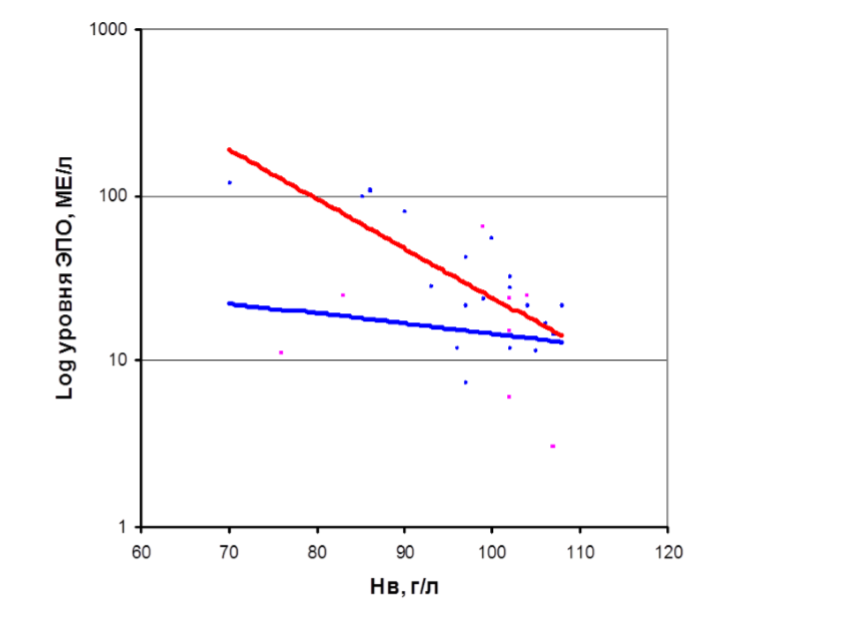
В клинической практике уровень с-ЭПО <100 МЕ/л при НЬ <100 г/л может служить индикатором неадекватно низкой продукции ЭПО степени тяжести анемии и предиктором эффективного ответа на рчЭПО-терапию.
Уменьшение продукции ЭПО при ЭДА приводит к гипопролифера-тивному эритропоэзу. Получен ряд убедительных данных, что неадекватно низкая продукция ЭПО является следствием воздействия провоспалительных цитокинов (IJ.-1.TNF-аи INF-y). Повышенные плазменные концентрации этих цитокинов описаны у пациентов с различными ЭДА. Выявление неадекватно низкой продукции ЭПО у пациента с анемией.
1.3. Протокол применения рекомбинантного человеческого эритропоэтина для лечения АХБ у детей и подростков
Показания к применению:
Hb < 100 г/л
Противопоказания к применению:
-
гематокрит свыше 0,6;
-
лейкоцитоз свыше 40×109/л;
-
тромбоцитоз свыше 700×109/л;
-
индивидуальная непереносимость препарата
Сроки лечения:
-
продолжительность терапии до 12 недель.
Режимы дозирования:
150-300 МЕ/кг 3 раза в неделю подкожно или 600 МЕ/кг 1 раз в неделю внутривенно.
Терапевтический режим:
-
стартовая доза рч ЭПО - 150 МЕ/кг
-
на фоне лечения рчЭПО необходимо дополнительно назначать внутрь или внутривенно препараты железа в суточной дозе не более 5 мг/кг для профилактики функционального дефицита железа.
Лабораторный контроль:
-
общий анализ крови с подсчетом количества эритроцитов, гемоглобина, гематокрита, ретикулоцитов, тромбоцитов перед началом терапии и на фоне лечения каждые 7-10 дней.
Требования к результатам лечения:
-
целевой уровень Hb – 110 г/л
Коррекция дозы рч ЭПО:
При отсутствии полного терапевтического ответа через 2 недели применения рч- ЭПО в дозе 150 МЕ/кг, определяемого как повышение уровня гемоглобина на ≥ 10 г/л от исходного при отсутствии трансфузий эритроцитарной массы, разовая доза препарата увеличивается на 50 МЕ/кг. Последующее увеличение дозы рч-ЭПО предусматривается каждые 2 недели на 50 МЕ/кг при условии недостаточной скорости прироста уровня гемоглобина (< 5 г/л в неделю), максимально 300 МЕ/кг. Если доза в 300 МЕ/кг не дает эффекта, дальнейшее повышение дозы нецелесообразно. Максимальная продолжительность введения рч-ЭПО – 12 недель. Если уровень Hb повышается чрезмерно быстро (более чем на 20 г/л в неделю) или если его концентрация превышает 120 г/л, следует прекратить введение препарата.
Применение ЭСП при АХБ у детей патогенетически обосновано, однако имеет недостаточную доказательную базу. Необходимы многоцентровые рандомизированные исследования для того, чтобы высказаться за или против применения ЭСП при АХБ в педиатрической практике. До этих пор применение ЭСП возможно в рамках исследовательских протоколов, а также в некоторых исключительных случаях, например, по религиозным убеждениям, как альтернатива гемотрансфузиям.
Диспансерное наблюдение
Учитывая симптоматический характер анемического синдрома, продолжительность наблюдения определяется клиникой основного заболевания.